(通讯员 郎利晓)8月18日,华中科技大学生命学院的教育部分子生物物理重点实验室刘剑峰教授研究团队在国际知名期刊《Proceedings of the National Academy of Sciences of the United States of America》上发表了题为《Illuminating the allosteric modulation of the calcium sensing receptor》的研究论文,阐释了钙离子敏感受体的变构调节机制。
细胞能够通过受体感受外界环境中的多种营养物质,如离子、氨基酸、糖、脂质等。G蛋白偶联受体(G protein-coupled receptors)是细胞膜上最大的膜受体超家族,也是重要的药物靶点,众多营养物质的感受都是由该类受体介导的。钙离子敏感受体(calcium-sensing receptor)是一种典型的感受营养物质的G蛋白偶联受体,能够被多种内源性或外源性物质(如阳离子、氨基酸、多胺、氨基糖苷类抗生素等)激活和调节。钙离子敏感受体主要位于甲状旁腺中,通过调节甲状旁腺激素的分泌,维持体内钙离子等多种离子的稳态。此外,在其它器官和组织如骨骼、肠道、肾脏中,它也在代谢等生理活动中起到重要的作用。在病人中已经发现了众多钙离子敏感受体的遗传突变和自身抗体,这些异常会导致多种相关的代谢紊乱病症。目前市面上仅存在三种靶向钙离子敏感受体的药物,但仍不足以满足治疗相关疾病的需求。
钙离子敏感受体属于C族G蛋白偶联受体,与同族的代谢型谷氨酸受体、B型γ-氨基丁酸受体和I型味觉受体同源性较高。除去所有G蛋白偶联受体共同拥有的七次跨膜结构,C族受体在胞外存在一个较大的捕蝇草结构域。不同于其它家族的G蛋白偶联受体主要通过七次跨膜结构结合配体,C族受体正是通过胞外的捕蝇草结构域识别配体的。尽管目前已有两个研究团队解析出钙离子敏感受体胞外区的晶体结构,但这些结构并没能很好地回答钙离子是如何激活受体的、氨基酸在激活过程中起到什么作用等重要问题。
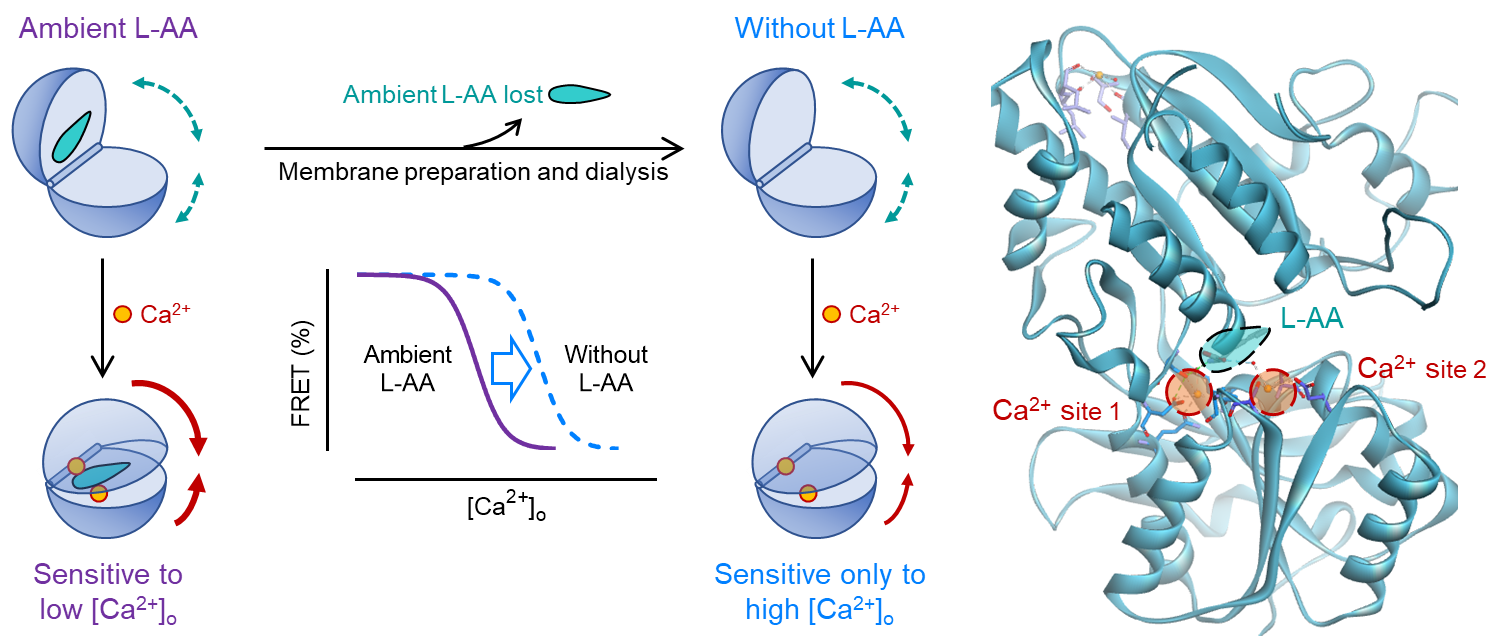
图:氨基酸作为正向变构调节剂、协同钙离子激活钙离子敏感受体示意图
为此,本研究首先通过荧光共振能量转移技术,构建了钙离子敏感受体的构象变化感应器,证明了该方法检测到的信号能够很好地反映受体激活情况。由于激活时的构象变化为受体的固有特性,并不依赖下游信号通路组件,因此这种检测可以在提取的细胞膜上进行,避免细胞环境中各种营养物质对受体激活的潜在影响。在这种高度可控的检测体系下,配合其它功能实验手段的验证,本研究发现钙离子本身就足以介导完整的受体构象变化,且很可能是通过位于捕蝇草结构域中配体氨基酸两侧的功能性结合位点实现的。与钙离子相比,氨基酸本身并不能导致受体的激活,但可以作为正向变构调节剂增强钙离子激活受体的效能。此外,本研究还发现氯离子对钙离子敏感受体也有较强的正向变构调节效应。阳离子、阴离子和氨基酸三者协同作用使得钙离子敏感受体能够感应较小幅度的钙离子浓度变化,保证受体能够正常发挥生理功能。本研究中检测细胞膜中受体构象变化、避免细胞环境中营养物质干扰的方法和策略将有可能应用于其它受体的研究上;相关研究发现对现知的钙离子敏感受体激活机制进行了优化和补充,有助于深入理解一些遗传突变对受体激活带来的影响,也为后续创新型药物的研发奠定了基础。
据悉,此项工作是由华中科技大学生命学院教育部分子生物物理重点实验室、科技部感知生物技术国际联合实验室的博士研究生刘弘康等人完成的,实验室刘剑峰教授和法国功能基因研究所的Pin JP 教授为文章的共同通讯作者。文章得到了国家自然科学基金委国际合作重点项目、国家留学基金委中法蔡元培交流合作项目和教育部111引智计划的支持。