肠道菌群通过复杂的代谢网络与宿主互作,影响代谢综合征、炎症、癌症等多种疾病。其中,嗜粘蛋白阿克曼氏菌(A. muciniphila)作为特异性降解粘蛋白的肠道土著菌,因其改善宿主代谢紊乱、精神系统疾病、增强宿主免疫应答等功能,被视为下一代益生菌的重要候选,但其响应宿主信号的机制尚不明确。肠道菌群代谢产生的气体分子因其高扩散性,可以广泛调控菌群稳态及宿主生理活动。CO₂作为肠道主要气体之一,参与微生物pH稳态、能量代谢及生物合成,但其对A. muciniphila的具体作用机制尚未阐明。本研究聚焦于CO₂对A. muciniphila生长及功能的调控,结合开发出的新型递送系统(CIAs)在肠道降解产生大量CO2,提高肠道中A. muciniphila的丰度,并可以缓解在饮食诱导肥胖小鼠的相关表型。本文同时解析了CO₂对人类肠道菌群组成和代谢功能的全局影响,为气态小分子介导靶向菌群的疾病干预提供理论依据。
2025年2月23日,华中科技大学生命学院刘智、陈卫华教授团队在The ISME Journal期刊上发表了题为“Carbon Dioxide Enhances Akkermansia muciniphila Fitness and Anti-obesity Efficacy in High-Fat Diet Mice”的研究论文。

在实验室培养肠道共生菌A. muciniphila过程中,研究者偶然发现,与横置相比,在竖直放置的厌氧试管中的A. muciniphila生长更好。结合多组学研究与培养实验,最终确认A. muciniphila通过感应自体产生的二氧化碳(CO₂)促使其快速生长。其中,谷氨酸脱羧酶(GAD)、碳酸酐酶(CA)和丙酮酸铁氧还原酶(PFOR)等关键酶在A. muciniphila的CO₂代谢中发挥关键作用。
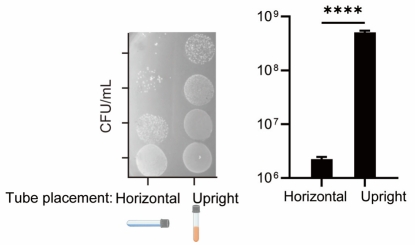
与水平放置相比,竖直放置的厌氧试管中A. muciniphila的生长更好
基于此,团队开发了一种新型递送系统(CIAs),通过碳酸钙、菊粉、海藻酸钠与A. muciniphila的组合,通过产生CO2,显著增强该菌在小鼠肠道内的存活及益生基因的表达。实验表明,CIAs可有效降低高脂饮食小鼠的体重、血脂及脂肪组织炎症水平。此外,基于对人源样本的培养,本研究发现CO₂对人类肠道菌群组成和功能具有显著的调控作用,尤其促进如双歧杆菌等多种益生菌的富集,并影响脂多糖合成等代谢通路。本研究为利用CO₂调控肠道菌群及开发基于活菌递送的抗肥胖疗法提供了新策略。
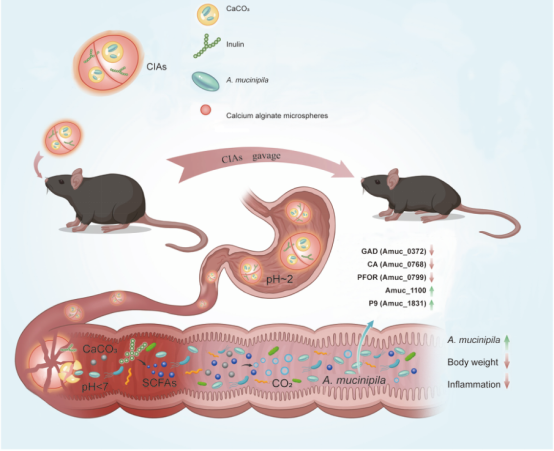
二氧化碳递送系统CIAs提高肠道A. muciniphila丰度,改善高脂饮食诱导小鼠肥胖
华中科技大学生命学院刘智教授、陈卫华教授、昆明医科大学张瑞林教授和杨红菊教授为共同通讯作者。华中科技大学生命科学与技术学院博士生王向峰和杨倩倩为共同第一作者。华中科技大学生命科学与技术学院为第一完成单位。
近年来,华中科技大学生命科学学院刘智教授团队致力于深入研究肠道微生物资源的开发与利用,深入揭示益生菌应答宿主信号,参与宿主免疫、代谢调节的分子机制,以期为理解肠道微生物与疾病治疗提供科学依据。近5年,该团队的研究成果已在包括《Cell Host & Microbe》、《Advanced Science》、《Microbiome》、《Nucleic Acids Research》、《Gut Microbes》等国际知名学术期刊上发表。
该研究得到了国家重点研发计划、国家自然科学基金、云南省重点研发计划项目、云南省自然科学基金、云南省创新团队项目、云南省应用基础研究项目、云南省昆明医科大学联合基金项目和云南省“高层次人才培养支持计划”的支持。
论文链接:https://doi.org/10.1093/ismejo/wraf034