(通讯员 王强)2022年2月18日,我校生命科学与技术学院、国家纳米药物工程技术研究中心李子福教授、杨祥良教授在国际著名期刊Chemistry of Materials上发表了题为“Influence of Linkers within Stimuli-Responsive Prodrugs on Cancer Therapy: A Case of Five Doxorubicin Dimer-Based Nanoparticles”的研究论文。
在新药的研发中,前药策略已成为经典的药物设计方法,其理论基础是前药可在体内经酶或化学作用下,释放活性分子,从而发挥药理作用。近年来,包含小分子药物偶联物(SMDC)、多肽-药物偶联物(PpDC)、高分子聚合物-药物偶联物(PDC)、抗体-药物偶联物(ADC)、以及新兴的核酸适配体-药物偶联物(ApDC)等偶联前药都在恶性肿瘤的治疗中得到了蓬勃的发展。
连接子是上述前药偶联药物的重要组件,决定着药物在病灶部位的释放速率与量。针对恶性肿瘤的治疗,常用的可切割连接子包括:腙键、二硫(硒)键、硼酸酯、硫缩酮、偶氮苯、多肽底物等。它们的裂解主要依赖于肿瘤特异性微环境,包括:弱酸性、高水平谷胱甘肽(GSH)和活性氧(ROS)、以及高表达蛋白酶(例如组织蛋白酶、基质金属蛋白酶等)。然而,面对如此繁杂的刺激响应源,在前药设计时,如何合理引入连接子,确保药物在肿瘤部位的高效释放成为亟待解决的问题。
基于以上背景,本研究设计并合成了五种不同连接子偶联的阿霉素(DOX)二聚体:稳定脂肪链连接的DOX2-CC、GSH响应且无原药释放的DOX2-SS(SH)、GSH响应且有原药释放的DOX2-SS、H2O2响应且有原药释放的DOX2-Bor和酸响应且有原药释放的DOX2-DMA,并在小鼠三阴性乳腺癌原位瘤和肝癌皮下瘤两种不同的荷瘤小鼠模型上比较了它们的抗肿瘤疗效。研究结果显示:在不同肿瘤模型中,这些阿霉素二聚体抗肿瘤活性顺序并不一致。进一步研究结果表明其抗肿瘤疗效受肿瘤内的刺激响应物浓度调控,不同的肿瘤维持胞内刺激物稳态能力也具有较大差异,进而导致DOX释放量不同。
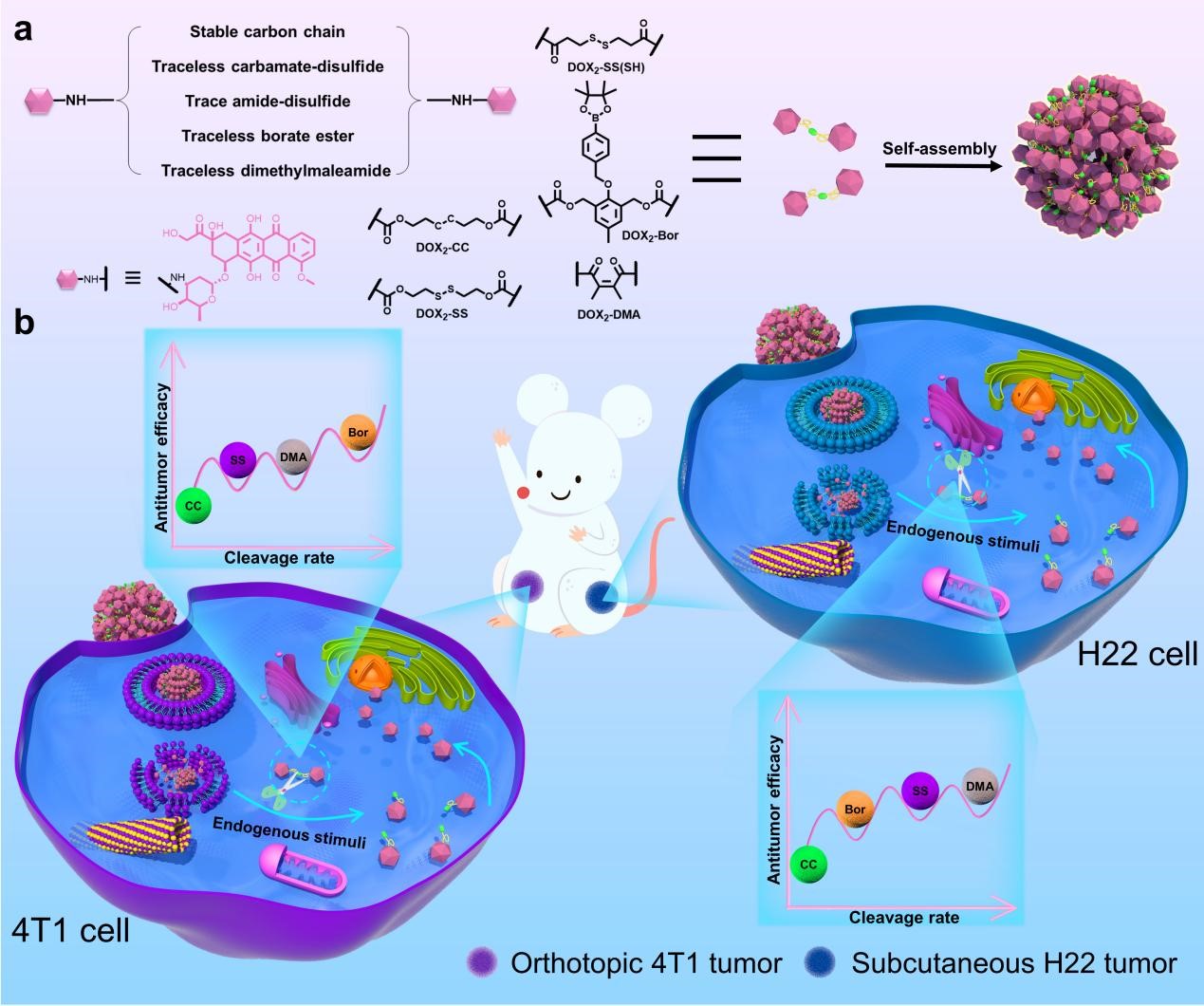
基于以上结果,本研究提出“精准无痕”的连接子设计策略。“精准”意味着在选择连接子时要充分考虑肿瘤间的异质性,不同类型的肿瘤具有不同的特异性内源性刺激物,且其维持刺激物稳态的能力具有差异。“无痕”代表在选择连接子时,我们要保证其能释放出原药。“精准无痕”的连接子策略保证了释放的药物作用于靶蛋白或核酸,进而充分发挥其药理活性。
华中科技大学生命学院博士生王强、王冲、李世友为该论文的共同第一作者。该研究得到国家重点研发计划(2020YFA0211200, 2020YFA0710700, 和2018YFA0208900),国家自然科学基金(31972927, 82172757),华中科技大学科研基金(3004170130)、华中科技大学学术前沿青年团队(2018QYTD01)以及华中科技大学登峰计划的资助。
文章链接:https://pubs.acs.org/doi/10.1021/acs.chemmater.1c03346