2024年3月12日,华中科技大学生命学院朱斌教授团队与武汉大学王隆飞教授团队合作在《Nature》杂志发表题为“Structures and activation mechanism of the Gabija anti-phage system”的研究论文。

论文链接:https://www.nature.com/articles/s41586-024-07270-x
DOI: 10.1038/s41586-024-07270-x
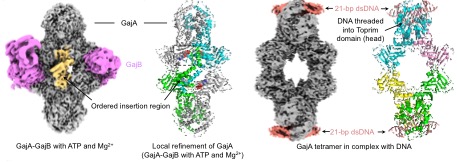
Gabija免疫是自然界已知丰度第三,仅次于限制修饰系统和CRISPR系统的原核生物免疫系统,仅由GajA和GajB两个基因组成却可以高效免疫各类烈性噬菌体的侵染,是自然界最广谱高效且精简的免疫系统之一。朱斌课题组基于长期的核酸酶研究基础首次揭示Gabija系统的分子机制:2021年发现GajA是一个受NTP浓度负调控的DNA缺刻酶,噬菌体侵入后高强度的转录降低了细菌细胞内NTP浓度,使GajA活性得以激活,对噬菌体和细菌自身DNA进行切割(Cheng et al., 2021, Nucleic Acids Research, doi: 10.1093/nar/gkab277);2023年发现GajB是一个受DNA末端激活的A/GTP水解酶,其激活信号是具有一定长度DNA的3’末端。GajA和GajB通过反应效果与激活信号的互补互相激活产生极联放大的正反馈循环,破坏细胞DNA同时清除重要代谢物A/GTP导致流产感染(Cheng et al., 2023, Cell Host & Microbe, doi: 10.1016/j.chom.2023.06.014)。本研究解析了Gabija复合物五种状态的冷冻电镜结构,阐明了ATP抑制、DNA结合与切割以及GajA和GajB相互作用的大量分子细节。近期已有包括两篇《Nature》在内的数篇高影响力论文报道Gabija复合物的冷冻电镜结构,Gabija免疫机制受到高度关注。
朱斌与王隆飞为共同通讯作者;武汉大学大学博士生李静、华中科技大学博士后成锐、武汉大学副研究员王之明为论文共同第一作者。本研究受到国家自然科学基金原创探索项目及深圳市基础研究重点项目等经费支持

研究介绍
朱斌教授长期专注于微生物核酸酶学基础研究,其团队以博物学思想为指导、从生物多样性取得灵感、坚持“求新”与“独创”,致力于从环境微生物这一分子水平的“新大陆”发现、采集与解析自然界新颖奇特的微生物核酸酶,根据酶功能特点揭示中心法则与原核生物免疫攻防的新机制并开发前沿生物技术工具酶。曾发现受核苷酸浓度调控的GajA 内切酶、感知DNA末端的GajB A/GTP水解酶,高原冰湖VSW-3 RNA 聚合酶、海洋病毒Syn5 RNA 聚合酶、来自深海无需引物的NrS-1 DNA 聚合酶、已知唯一病毒来源的修饰依赖限制性内切酶及唯一从DNA m6A修饰两侧切割的HHPV4I酶等来自环境微生物的多种新颖核酸酶;作为通讯作者于Nature、Nature Microbiology、Cell Host & Microbe、PNAS等顶级学术期刊发表多篇研究论文;曾获IUBMB青年科学家奖、春晖杯海外留学人员创新创业大赛一等奖、国家高层次海外青年人才、湖北省百人计划创业人才、东湖高新3551重点人才、生物医学峰基金等奖励。研究成果被Ribotech、近岸蛋白等开发为Ice lakeTM RNA聚合酶、Clean T7TM RNA polymerase、T7 RNA polymerase 2.0等商业化RNA合成工具酶。