2024年4月25日,《通讯生物学》(communications biology)在线发表了华中科技大学生命学院刘剑峰教授课题组题为“Absence of calcium-sensing receptor basal activity due to inter-subunit disulfide bridges”(分子间二硫键抑制钙敏感受体的组成型活性)的研究论文。
大多数C族G蛋白偶联受体(G protein coupled receptor,GPCR)具有组成型活性,且该活性处于精细的调控之中,以保证最佳的生理信号输出。钙敏感受体(Calcium sensing receptor,CaSR)属于C族GPCR,主要负责维持血钙浓度的稳定。CaSR始终处于多种配体(如激动剂钙离子、别构调节剂氨基酸等)包围的环境之中,严格的活性调控是其精准感知胞外钙离子浓度微小变化所必须的。CaSR同源二聚体的亚基间存在两个分子间二硫键,参与形成分子间二硫键的两个关键半胱氨酸残基存在许多天然突变,均为功能获得型突变,均会导致低钙血症。CaSR是否具有组成型活性及分子间二硫键是否调控其组成型活性值得关注。
刘剑峰教授课题组发现,与C族其它成员不同,CaSR组成型活性无法被检测到。破坏分子间二硫键会导致CaSR组成型激活,并增加受体对激动剂和正向别构调节剂的应答效力。针对发生在CaSR分子间二硫键位点上的天然疾病相关突变进行检测,发现这些突变体均具有组成型活性。研究表明,CaSR分子间二硫键缺失突变体的组成型活性依赖于氨基酸与受体的结合,一个氨基酸的结合足以引发突变体的激活效应。该工作探索了CaSR胞外区的特殊结构对受体活性的调节作用,提出了一个分子锁模型:即作为分子锁的分子间二硫键限制了CaSR胞外区的构象重排,抑制了氨基酸对CaSR的激动效应,LB2界面上的静电斥力可进一步加强这种抑制作用,使CaSR能够精准响应周围复杂的营养环境。研究结果完善了C族受体组成型活性的调控机制,为更好的理解CaSR的激活特征和该受体突变相关钙稳态失衡机制提供了新的理论基础。
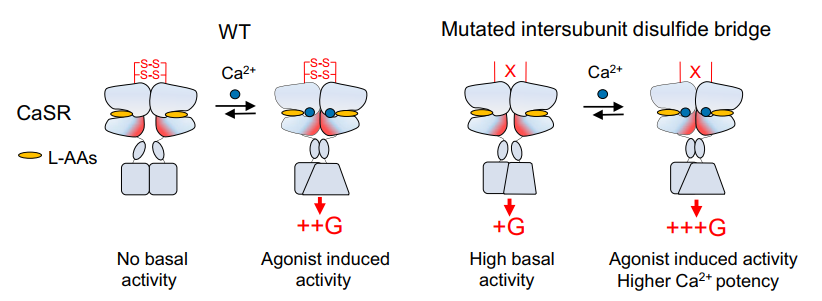
图:CaSR的激活过程示意图
华中科技大学生命学院刘剑峰教授、易平副教授、法国国家科学研究中心功能基因功能所Rondard P研究员为论文的共同通讯作者,华中科技大学生命学院博士生马淑敏为论文第一作者。华中科技大学生命学院为第一完成单位。该研究得到了国家自然科学基金和科技部“中法联合实验室”以及法国国家卫生科学研究中心国际合作项目支持。
论文链接:https://www.nature.com/articles/s42003-024-06189-3