华中科技大学生命科学与技术学院罗亮教授和河南大学生命科学学院师冰洋教授、邹艳教授的合作团队,在基于近红外可激活仿生纳米凝胶载体的原位胶质母细胞瘤抑制研究中取得最新进展。相关研究成果于11月11日以题为“Near infrared-activatable biomimetic nanogels enabling deep tumor drug penetration inhibit orthotopic glioblastoma”的研究论文,在线发表于《自然-通讯》(Nature Communications)。
多形性胶质母细胞瘤(GBM)是中枢神经系统最常见的原发肿瘤,约占颅内恶性肿瘤总发病率的40%。虽然现有手术切除,放射治疗,化疗等多重方法用于GBM的治疗。但因药物血液循环不足、血脑屏障(BBB)穿透受限和深层肿瘤药物摄取低等问题,致使患者治疗效果远低于预期,中位生存期仅为12个月。针对上述问题,研究团队通过交联普鲁兰糖和可氧化降解的聚二炔衍生物PDDA制备了近红外可激活的纳米凝胶体系,将FDA批准的近红外(NIR)光敏剂吲哚青绿(ICG)和治疗GBM的一线化疗药物替莫唑胺(TMZ)载入纳米凝胶中,用载脂蛋白E (ApoE)修饰的红细胞膜仿生包覆,开发了一种近红外可激活的仿生纳米凝胶给药系统ARNGs@TMZ/ICG。

与其他光响应型药物递送系统相比,基于PDDA的纳米凝胶能够在近红外光照的条件下高效快速激活,而在生物内源性条件下具有一定的稳定性,这对于提高其在循环系统中的稳定性,避免在非肿瘤微环境中可能发生的药物泄漏具有重要意义。研究发现,近红外光照射ICG产生活性氧(ROS),触发PDDA骨架降解,整个纳米载体的力学性质变得更加柔软,触发局部药物高效释放的同时有利于药物对深部肿瘤组织的渗透。因此,这种激活过程特别有利于在GBM深层病变中维持较高浓度的TMZ和ICG。
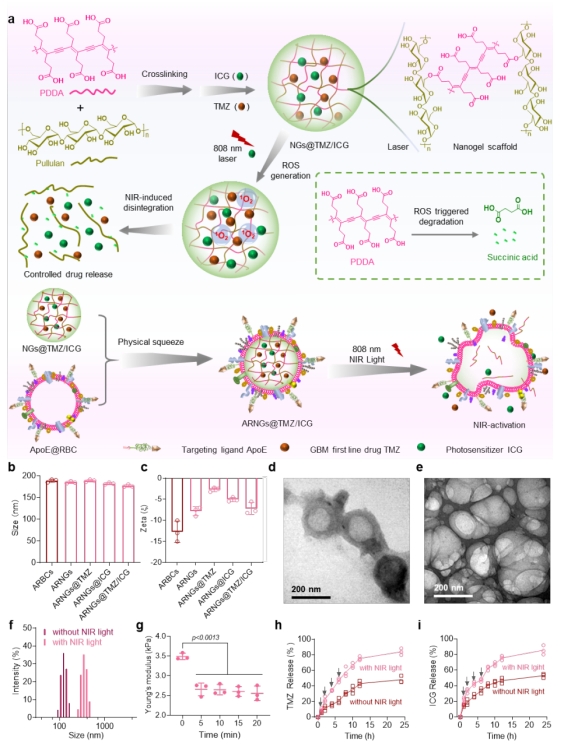
基于PDDA的近红外高效激活纳米载体
在通过静脉给药后,ARNGs@TMZ/ICG纳米载药系统利用表面的靶向分子在脑胶质瘤组织高效富集。随后通过近红外辐射ICG产生的活性氧ROS在肿瘤部位精确地激活了ARNGs@TMZ/ICG。ApoE功能化红细胞膜的修饰进一步延长了循环时间,改善了肿瘤聚集,并促进了纳米凝胶的血脑屏障渗透。当纳米凝胶达到有效的肿瘤聚集后,可以通过ICG荧光示踪,在合适的时机通过近红外光照激活纳米载体。基于以上的设计策略,这种仿生纳米凝胶在原位U87 MG和GBM干细胞(CSC2)肿瘤模型中都表现出高效的抗GBM功效,且具有良好的生物相容性和较低的毒副作用,中位存活时间提高近三倍。因此,与类似的靶向配体修饰的响应性纳米系统相比,ARNGs@TMZ/ICG更有效地抑制了原位GBM。总体来说,这项研究表明基于PDDA的近红外可激活纳米凝胶不仅具有作为治疗恶性胶质母细胞瘤的潜在治疗平台的优势,而且为设计精确可控的纳米载体实现原位肿瘤的高效治疗铺平了道路。
河南大学生命科学学院博士生张东亚和华中科技大学生命科学与技术学院田斯丹博士为论文共同第一作者,华中科技大学生命科学与技术学院罗亮教授、河南大学生命科学学院冰洋教授和邹艳教授为论文共同通讯作者。华中科技大学生命学院杨祥良教授,河南大学生命科学学院郑蒙教授和韩国国家癌症中心研究所特定器官癌症分部的Jong Bae Park教授为本论文的研究工作提供了重要的指导和帮助。该工作得到了国家重点研发计划、国家自然科学基金和河南省高校科技创新人才计划的资助。
论文链接:https://www.nature.com/articles/s41467-022-34462-8