华中科技大学生命科学与技术学院杨祥良教授和张燕副教授在蛋白酶激活型纳米酶用于光声/磁共振引导的肿瘤铁死亡-光热联合治疗取得新进展。相关研究成果以题为“Protease-Activatable Nanozyme with Photoacoustic and Tumor-Enhanced Magnetic Resonance Imaging for Photothermal Ferroptosis Cancer Therapy”的研究论文,发表在Advanced Functional Materials。
铁死亡(Ferroptosis)是一种铁依赖型细胞程序性死亡方式。铁死亡的主要机制是在二价铁或酯氧合酶的作用下,产生过量的羟基自由基(·OH),催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞铁死亡;其还表现为谷胱甘肽的耗竭,谷胱甘肽过氧化物酶(GPX4)活性下降。开发高效的铁死亡诱导药物是抗肿瘤治疗的有效方式之一。然而,目前铁死亡诱导药物存在系统给药后药物全身分布毒性大、肿瘤细胞杀伤效果有限等不足。针对上述问题,研究团队选择以明胶为模板、通过金属配位作用制备Fe3O4纳米簇,联合缺陷型Cu1.77Se,开发了金属基蛋白酶激活的Fe3O4@Cu1.77Se纳米酶。
与其他纳米酶相比,该纳米酶在生理环境中能保持结构和性能稳定;在基质金属蛋白酶存在时,Fe3O4@Cu1.77Se能够快速解聚,释放超多、超小的Fe3O4和Cu1.77Se纳米粒,不仅引起纳米酶核磁共振T2信号增强,而且提高了Fe3O4@Cu1.77Se的(类)Fenton反应效率,增强其羟基自由基(·OH)产生和GSH消耗效率。同时,Cu1.77Se具有较好的近红外II区光热转换效率,在1064 nm照射时,不仅能产生很好的光热效应,而且能进一步增强纳米酶(类)Fenton反应和GSH消耗效率,实现1+1>2的协同效果。
静脉给药后,在外源磁场的引导下,Fe3O4@Cu1.77Se纳米酶能在肿瘤组织中高效富集。在肿瘤组织富含基质金属蛋白酶和外源1064 nm光源共同作用,Fe3O4@Cu1.77Se纳米酶不仅能有效增强肿瘤细胞膜的脂质过氧化,显著增强肿瘤细胞铁死亡过程,同时产生光热效果,实现1+1>2的协同抗肿瘤治疗疗效。该治疗过程有效诱导肿瘤细胞免疫原性死亡,激活树突状细胞成熟,导致毒性T淋巴细胞的浸润,同时引起肿瘤相关巨噬细胞逆极化,从而激活免疫反应,有效抑制近、远端肿瘤的生长和肿瘤的肺转移。
这项工作为设计肿瘤原位激活型铁死亡纳米药物提供了思路,通过有效避免铁死亡诱导药物在非肿瘤微环境中发生的脱靶效应带来的潜在伤害,实现抗肿瘤的协同、高效治疗。
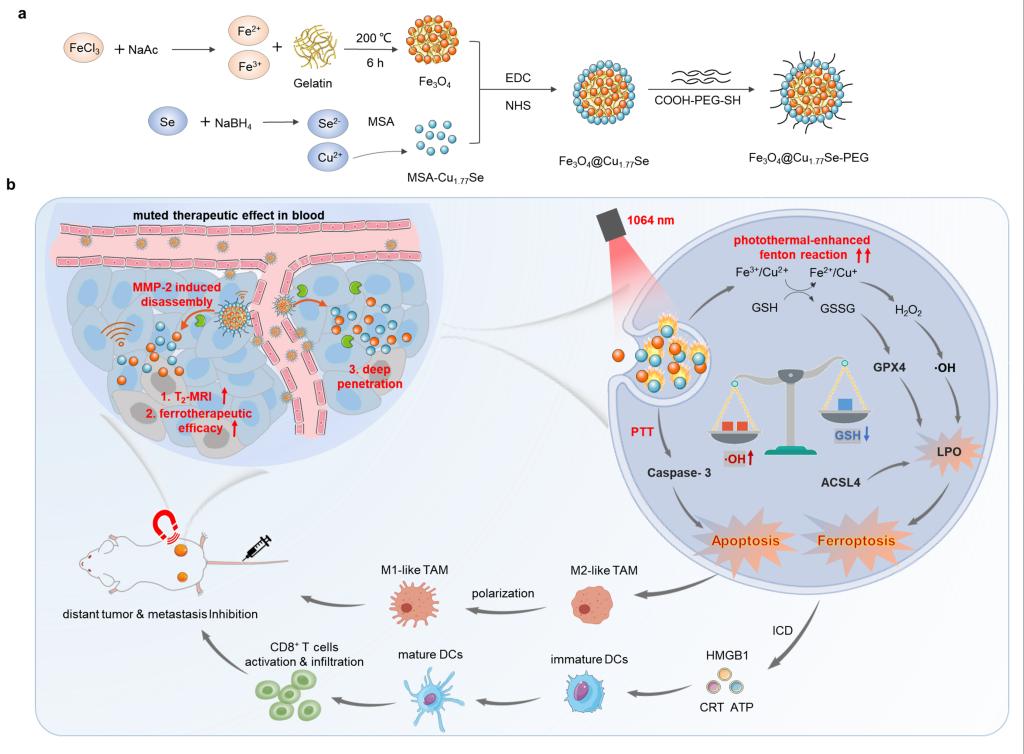
图1. 蛋白酶激活型纳米酶Fe3O4@Cu1.77Se构建、治疗效果评估及机理
生命科学与技术学院博士生秦文、黄金钊为论文共同第一作者,华中科技大学生命科学与技术学院张燕副教授为论文通讯作者。该工作得到国家重点研发计划(2021YFA1201200)的资助。