2024年8月12日,我校生命科学与技术学院李一伟教授团队、联合麻省理工学院郭明教授应邀攥写并发表综述,该综述深入探讨了基于体积挤压的创新工程方法,详细介绍了其理论基础及设计原则,在再生器官工程、再生治疗、合成生物学、可穿戴器件等领域探讨应用实例,为相关研究领域提供了宝贵的参考。相关工作以“Volumetric compression for engineering living systems”为题发表在Nature Reviews Bioengineering上。该论文可以通过此链接查看https://rdcu.be/dQFgv。

细胞是生命的基本组成单元,也是生物大分子等一系列软物质的浓缩的体现。由于生命中不间断的动态生物学过程(发育、肢体运动、消化到肿瘤形成及损伤修复等),细胞在人体中受到的体积挤压无处不在。在体积压缩下,细胞内的水含量、生物大分子的浓度、分子拥挤程度以及生物分子的凝聚状态时刻发生着动态变化。这一系列分子尺度的变化,也逐级影响着分子信号转导、无膜细胞器形成、细胞命运与功能调控、乃至组织器官的系统性发育。细胞体积压缩的广泛影响遍及不同的组织乃至物种。理解利用并工程化体积挤压这一普遍现象,我们可以在再生医学、人造器官、合成生物学、生物传感和免疫治疗等领域取得重要突破。
在本综述中,作者聚焦在细胞体积挤压这个常见且重要,但往往被忽视的生命现象。该综述首先介绍了细胞体积的概念的由来,细胞体积概念的提出是随着细胞的发现而来。尽管细胞体积挤压随处可见,但是其对生命过程的影响不容忽视,论文首先以人体为例,介绍了无论是生理过程(肢体运动、消化过程、肾脏重吸收、心血管压力等)还是病理过程(肿瘤发生发展、炎症反应、伤口修复等),细胞无时无刻不承受着不同形式的体积挤压,而细胞挤压形式的不同,往往影响着不同的生物学过程并影响着宏观机体上的生命过程。
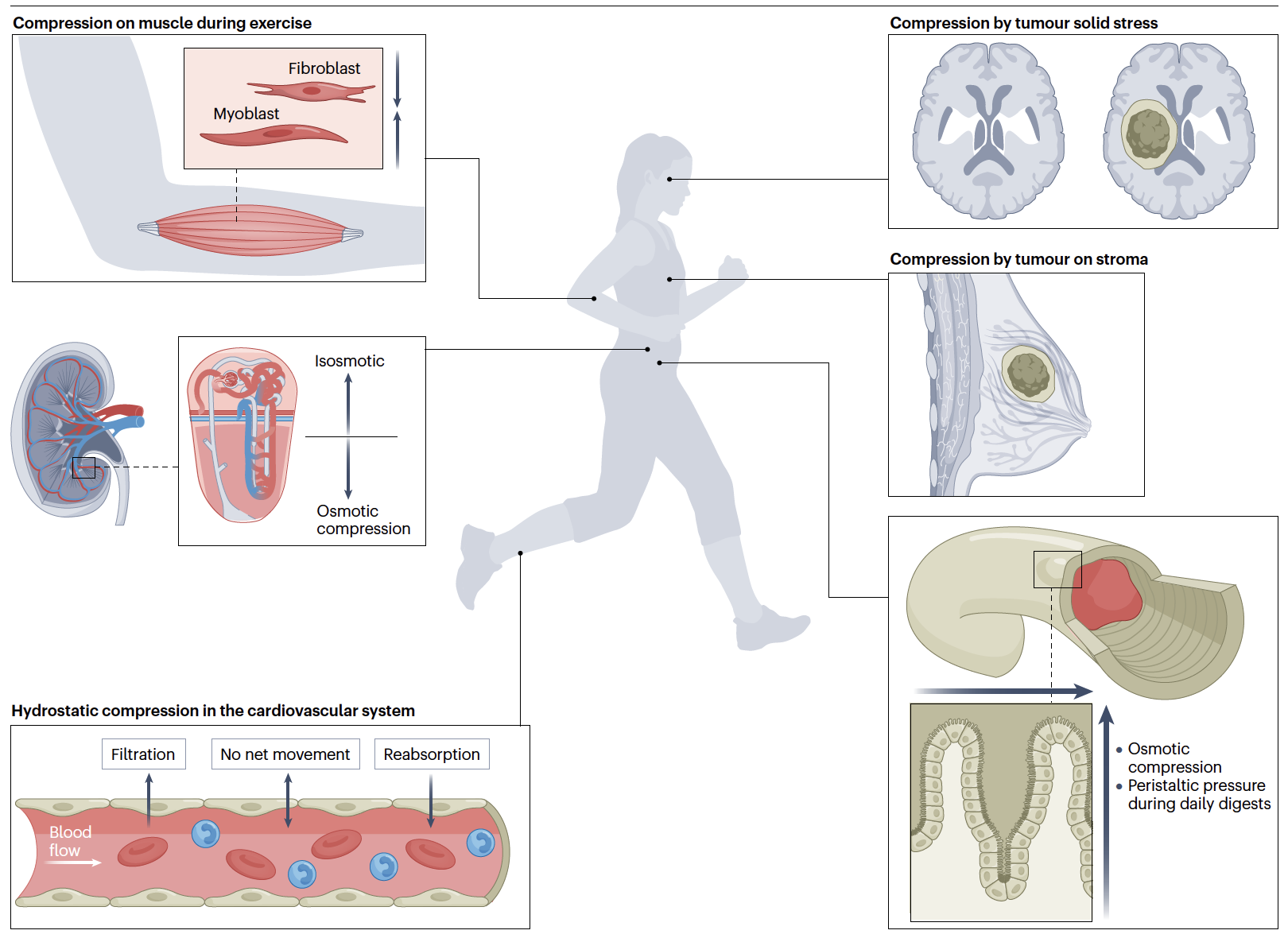
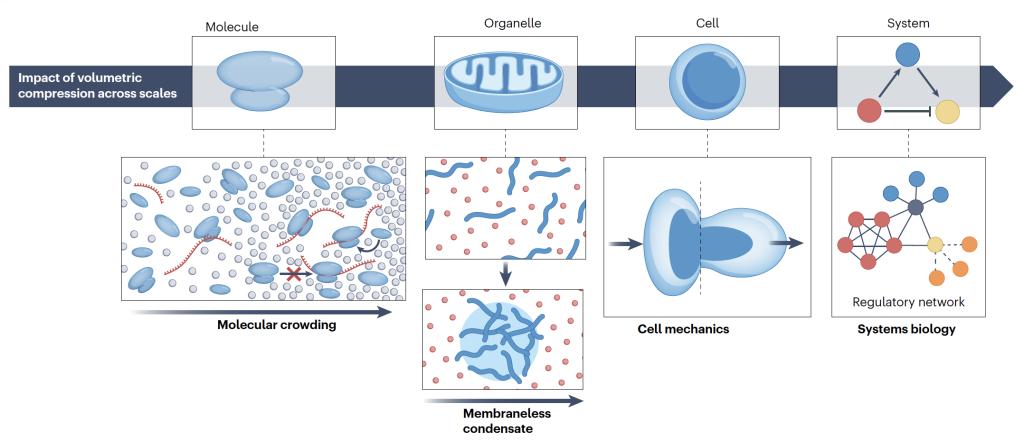
从生物学影响上看,细胞体积本身与细胞的生长、分裂、分化、迁移一系列的基本生命过程直接相关。该综述进一步介绍,随着近年来分子生物学和近代生物医学的发展,研究表明,细胞体积挤压在不同的尺度上均存在着重要的生物学意义:在分子尺度,细胞体积挤压通过影响分子拥挤,广泛的调控着分子信号转导和基因表达;在细胞器尺度,细胞体积挤压广泛的影响着蛋白质相分离及无膜细胞器的形成,从而条件细胞器之间的互作网络;在细胞尺度,不同的细胞物理力学性质与细胞体积相耦合、并调控着细胞代谢、生长与命运转变;在系统尺度,细胞体积调控的物理性、广谱性和细胞种类特异性可能以调控网络的形式影响着细胞内的复杂系统以及组织器官尺度细胞间互作的复杂系统,从而直接影响着组织器官再生与疾病的发展与治疗。
从探讨细胞体积挤压生物学意义的同时,作者也详细介绍了细胞体积调控的物理机制,从细胞体积调控的决定性的分子事件,到细胞生长引起的细胞体积变化,再到细胞体积调控上下游的分子事件的不同时间尺度,进行了详细的探讨。另外一方面,也系统的从物理、力学角度详细介绍了上游调控细胞体积挤压的细胞外微环境信号。
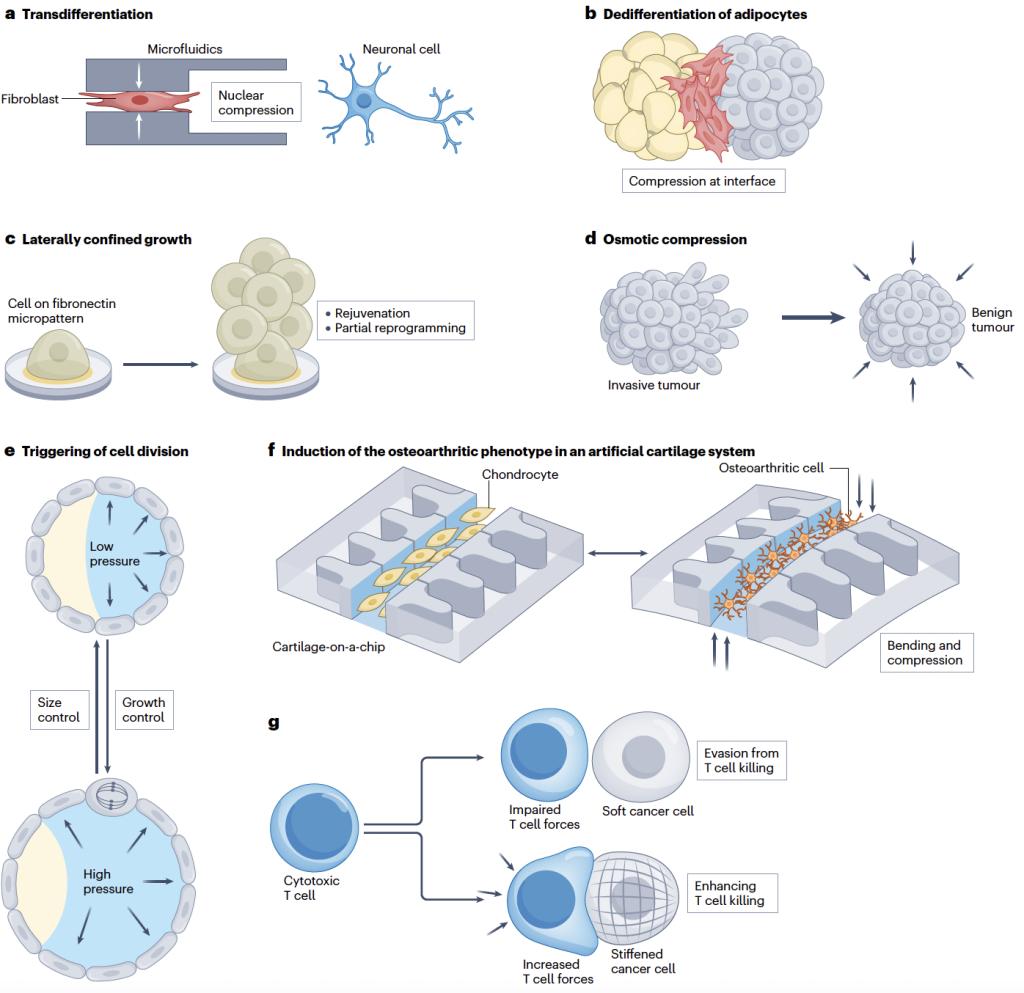
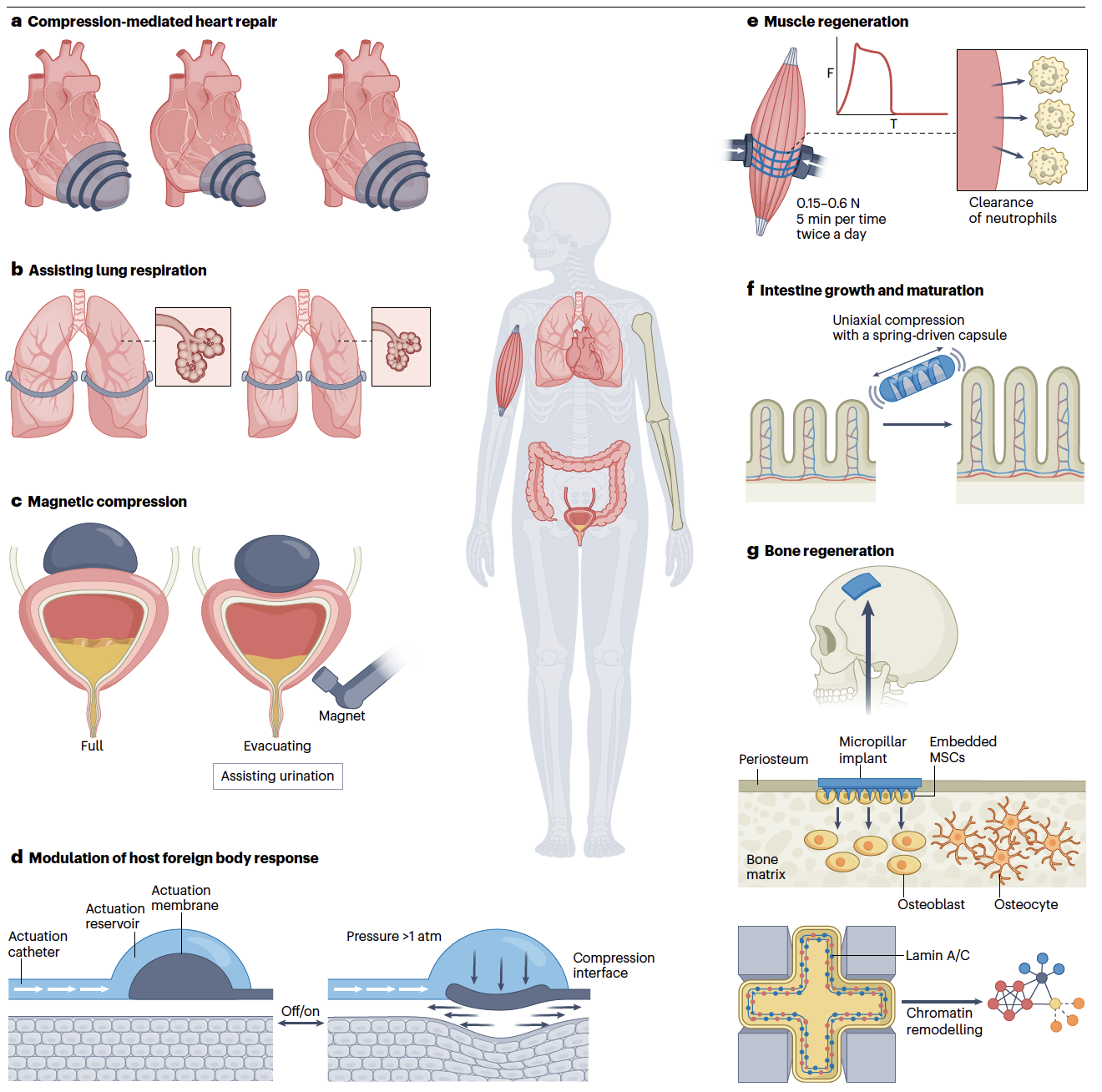
最后,该论文提出,工程化细胞体积挤压将在再生医学、合成生物学及可穿戴医疗设备等领域起到重要的作用。细胞体积挤压不同于传统的基因编辑和化学小分子刺激,为生物工程提供了生物安全性更高、可调节性更强、互补且更加柔和的生命系统工程化方案。在再生医学领域,作者以应用实例说明了细胞体积挤压如何有效应用于调控细胞转分化、重编程、回春抗衰老、干预胚胎发育、调控人造胚胎、疾病模型构建、类器官发育构建以及细胞治疗等。在人造细胞合成生物学领域,作者进一步阐述,如何启发于细胞体积挤压,在人造细胞系统中调控分子动力学、造型人造细胞、调控类无膜人造细胞器形成、改造基因表达网络、模拟细胞命运转变以及模拟细胞异质性基因表达等。在可穿戴医疗设备上,论文首先介绍了现有可穿戴/植入医疗设备通过器官尺度挤压实现的肺功能优化、辅助排尿、肠道再生、颅骨再生、肌肉再生和免疫调控等,并进一步提出,未来的医疗设别可以实现细胞尺度的精准体积挤压,不单单是从整体水平辅助人体器官的功能,也从细胞乃至分子水平精准实现组织再生、器官功能恢复及疾病治疗等。
该综述作者之一,李一伟教授团队长期重点关注细胞体积挤压这一常见却被忽视的基本生命现象,研究其物理分子机制,及对生命、再生、治疗的影响,并进一步将体积挤压力学设计和分子信号转导结合,实现了带有功能的微组织、类器官构建,包括脂肪、肿瘤、肌肉和小肠等,实现产业转化。在分子尺度上,李一伟教授率先发现细胞体积挤压调控Wnt/β-catenin信号通路的调控机制(Cell Stem Cell, 2021), 李一伟教授首次解析了细胞体积挤压如何调控基因表达动力学及影响基因表达噪音过程(PNAS, 2021);在细胞器尺度,李一伟教授报道了首个受到细胞体积调控的无膜细胞器LRP6信号体(Cell Stem Cell, 2021),是调控Wnt信号通路和干细胞命运的关键,并进一步首次大规模发现了受到细胞体积挤压力学调控相分离蛋白质1215种,并提供了一种力学启发、组学水平大规模发现相分离蛋白质新方法(Nature Chemistry, 2024);在细胞及组织水平,李一伟教授报道了细胞体积挤压调控的成体细胞去分化重编程(Science Advances, 2020), 细胞体积挤压调控的干细胞分化(PNAS, 2019),细胞体积挤压调控的类器官发育生长(Cell Stem Cell, 2021)。