2025年7月2日,华中科技大学生命学院闫云君团队在国际权威期刊《Nucleic Acids Research》在线发表了题为“CARF-dependent preferential RNA cleavage by Csm6 increases drug susceptibility of mycobacteria”的研究论文。
论文链接:https://doi.org/10.1093/nar/gkaf622

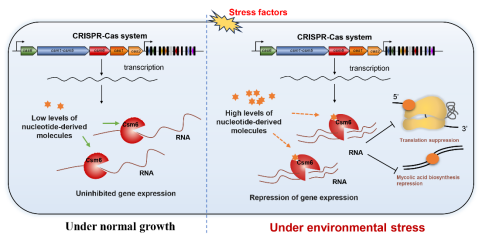
CRISPR-Cas系统是原核生物的适应性免疫系统,用于抵御入侵的可移动遗传元件。其中,III-A型是一种在结核分枝杆菌和金黄色葡萄球菌等病原菌中广泛存在的CRISPR-Cas系统亚型。该系统包含9个编码基因,是最复杂的CRISPR-Cas系统之一。其中,Csm6蛋白具有HEPN核糖核酸酶结构域,被认为是抗病毒过程中降解外源RNA的关键蛋白。前人研究发现,Csm6的生物化学活性依赖于干扰复合物Csm产生的环寡腺苷酸(如cA6),这些分子作为第二信使结合Csm6的CARF结构域,变构激活HEPN域非特异性切割外源RNA。闫云君团队杨敏副教授基于长期的分枝杆菌基因表达调控机制研究基础,对III-A型CRISPR-Cas系统蛋白生物化学活性和生物学功能开展研究。结果发现:在缺乏CRISPR系统的耻垢分枝杆菌中异源表达结核分枝杆菌的Csm6,该蛋白展现出强烈的内源性RNA切割功能,且偏好切割核糖体蛋白相关基因和分枝菌酸合成基因的转录本。这种偏好性切割触发了双重破坏性级联反应:显著降低核糖体活性并严重破坏细胞壁完整性。尽管这种自毁效应协同作用不会影响细菌在非胁迫条件下的生长,但是却显著削弱了分枝杆菌的自我防御能力,从而使其对异烟肼、利福平等药物及双氧水等胁迫因子的敏感性大大增强。进一步研究发现,Csm6蛋白N端的CARF结构域是其偏好性切割活性的必要条件,是控制这种“自毁程序”的核心开关。而且,Csm6蛋白具有的这种偏好性切割能力的调控很可能与之前广泛认知的cA6途径存在差异。该研究打破了CRISPR系统蛋白非特异性切割外源核酸的经典认知,揭示了其在调节内源基因表达、介导适应性非免疫反应的新功能模式。研究结果为新型基因编辑工具的开发提供了新思路,同时为新型抗结核药物设计提供了潜在靶点和策略。
华中科技大学生命科学与技术学院博士后魏文凭为该论文的第一作者,杨敏副教授为通讯作者,闫云君教授、阎金勇教授参与了研究。华中农业大学高春辉副研究员及研究生江小芳、乔俊杰、张丽等也参与了研究。研究得到了国家自然科学基金和中央高校基本科研业务费资助。