在漫长的进化过程中,生命体产生了以24小时为周期的节律来适应外界昼夜环境变化。这种节律体现在各种生命活动中,例如人类以及其他许多动物的睡眠觉醒周期、植物的光合作用、真菌的产孢、细菌的分裂等。昼夜节律由体内的生物钟所驱动。生物钟和昼夜节律的紊乱不仅影响睡眠,还会增加罹患代谢疾病、癌症、精神疾病等多种疾病的风险。
2017年,美国科学家Jeffrey C. Hall、Michael Rosbash和Michael W. Young凭借在分子层面揭示果蝇生物钟所作出的巨大贡献,获得了诺贝尔生理学或医学奖。生物钟的分子调控机制在不同物种间高度保守,从原核生物如蓝细菌直到人类,蛋白激酶对时钟蛋白的磷酸化调控都是决定时钟运转速度的关键。磷酸化使得时钟蛋白在细胞中的定位、蛋白的稳定性以及蛋白的活性都呈现出以24小时为周期的振荡性变化,而这正是各种行为和生理过程的昼夜节律的分子基础。近年在小鼠肝脏中的研究发现节律性的磷酸化不仅仅存在于几个组成分子时钟的蛋白上,而是广泛存在于蛋白质组中,约1/4能检测到的磷酸化位点都存在昼夜节律!但是这些节律性的磷酸化的生理意义是什么,它们是如何调控的,这些问题还没有答案。
近日,华中科技大学生命学院张珞颖教授和薛宇教授团队在Nature Communications发表题为:Integrated omics in Drosophila uncover a circadian kinome的研究论文,尝试利用系统生物学的手段来研究蛋白质磷酸化的节律,探索它们的功能和调控机制。

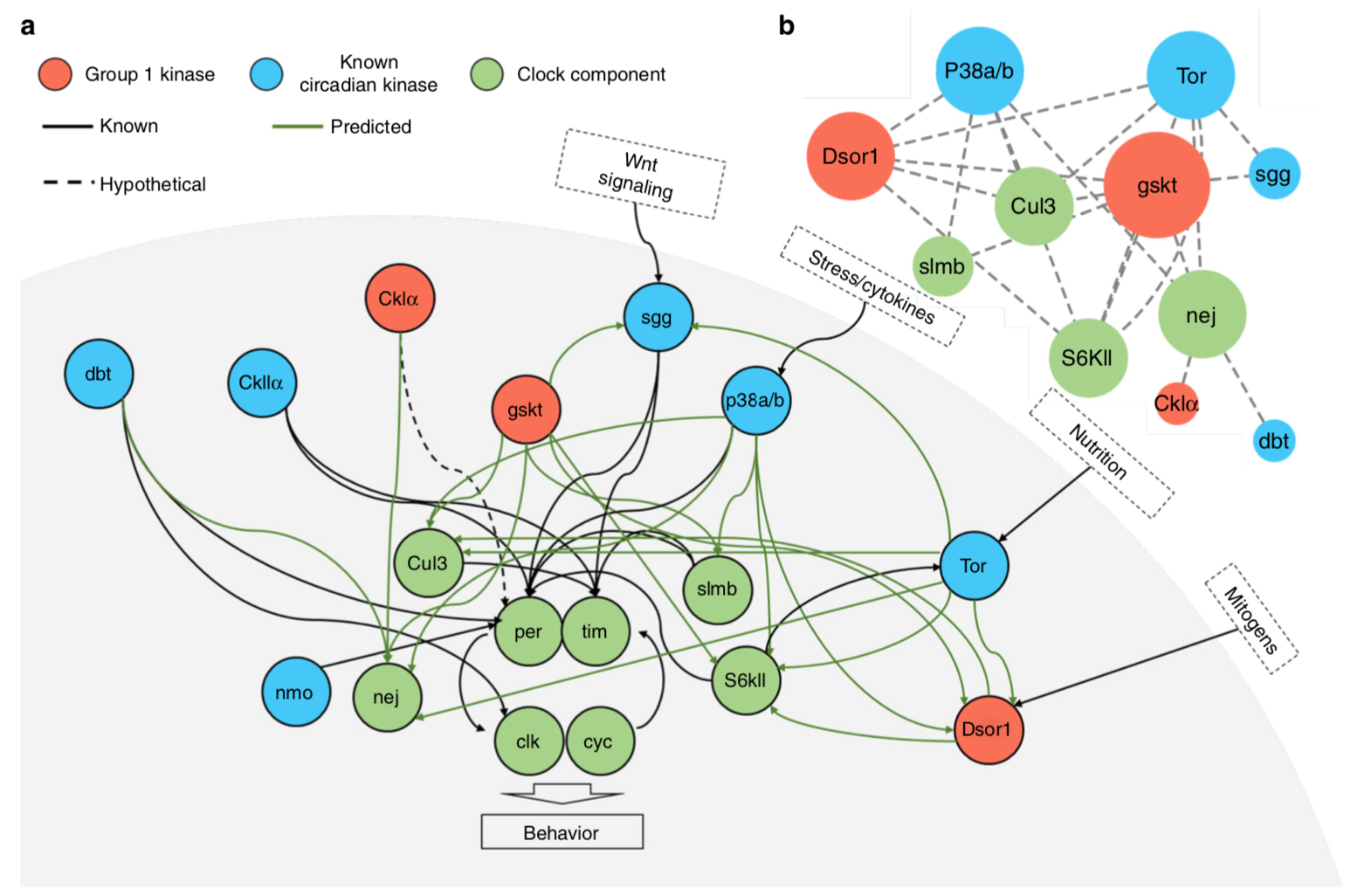
该研究通过整合果蝇头部转录组、蛋白组和磷酸化组的多组学数据,同时采用团队开发出的多组学数据整合节律算法iCMod(integrating circadian multi-omics data)进行分析,揭示出果蝇头部17%的磷酸化位点(789个)呈现出昼夜节律。在核心钟基因突变的果蝇中这些位点中的绝大多数丧失了节律性,表明这些位点的节律性磷酸化由分子时钟所驱动。团队利用iCMod预测了27个参与磷酸化这些位点的蛋白激酶,发现其中包括了已知的7个调控果蝇生物钟的重要激酶。接着团队对剩余的20个激酶进行检测,鉴定出3个新的调控果蝇活动节律的激酶。根据已知的和预测的激酶底物关系,团队针对这10个(包括7个已知的和3个新的)激酶构建了一个信号网络,此信号网络可以解释这10个激酶构成的激酶组如何调控分子时钟以及活动节律。根据预测结果,网络中的核心调控者是一个新的节律激酶GASKET(GSKT)。进一步分子层面的分析揭示GSKT可能通过下调钟蛋白TIMELESS的蛋白水平,实现对生物钟和活动节律的调控。
华中科技大学生命学院博士生王晨玮和税珂为论文的第一作者,薛宇教授和张珞颖教授为共同通讯作者,本研究受到国家自然科学基金、国家精准医疗专项、国家青年拔尖人才计划等项目的支持。
论文链接:https://www.nature.com/articles/s41467-020-16514-z