近日,我校生命科学与技术学院、国家纳米药物工程技术中心张燕副教授、朱艳红教授在国际知名期刊Angewandte Chemie International Edition上发表研究论文”Transformable Nanosensitizer with Tumour Microenvironment‐Activated Sonodynamic Process and Calcium Release for Enhanced Cancer Immunotherapy”,报道了一种智能响应型纳米声敏剂用于肿瘤声动力-免疫联合治疗。
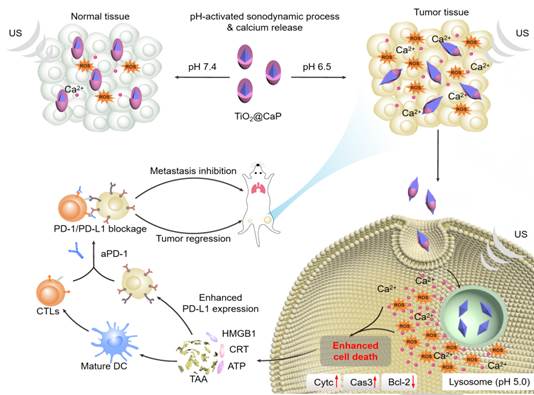
图1:可变形纳米声敏剂TiO2@CaP通过肿瘤酸性微环境激活SDT和Ca2+释放,协同增强肿瘤免疫治疗疗效
声动力疗法(sonodynamic therapy,SDT)是一种新兴的具有非侵入性、组织穿透性深的治疗方法,在治疗肿瘤等重大疾病有着巨大的潜力。SDT主要借助声敏剂在超声作用下产生具有声毒性和细胞毒性的自由基(reactive oxygen species,ROS)杀伤肿瘤细胞。目前,小分子声敏剂存在稳定性差、产生ROS性能差等问题。为了提高声敏剂的治疗效果,目前已经开发了多种纳米声敏剂,如Au-MnO、Au-TiO2等。然而,这些声敏剂分子对肿瘤细胞杀伤效率低、持续的药理活性导致组织选择差并且存在潜在脱靶毒性。
针对上述问题,我们以二氧化钛为内核,通过包覆磷化钙壳层,构建了具有肿瘤酸性微环境响应性的纳米声敏剂,有效增强了肿瘤声动力-免疫治疗疗效。磷化钙是一种具有良好生物相容性的材料,磷化钙壳层的包覆不仅赋予了二氧化钛纳米声敏剂在不同酸性条件下“可变性”特性,同时实现调节产生不同强度的ROS。因此,在肿瘤微环境酸性环境和肿瘤细胞溶酶体的作用下,一方面,磷化钙壳层的降解使二氧化钛纳米粒有效暴露于环境中,在超声刺激下产生大量ROS;另一方面,磷化钙壳层的降解能促进大量钙离子的释放,造成钙离子过载,也能促进ROS的产生。二者结合形成的级联增强效应能有效杀伤肿瘤细胞,促进肿瘤细胞凋亡。同时,肿瘤细胞的凋亡能诱发肿瘤的免疫原性死亡,增加免疫细胞浸润和杀伤性T细胞的产生,实现“冷”肿瘤向“热”肿瘤的转变。最后,通过联合PD-1检查点阻断疗法,有效抑制了近端、远端肿瘤的生长,同时显著抑制了肺转移的发生。该策略构建的肿瘤微环境响应性的纳米声敏剂具有高度的时空特异性,能有效增强肿瘤免疫疗法的治疗效果,为肿瘤治疗提供一种新的策略。
生命科学与技术学院硕士生谭萱、博士生黄金钊和硕士生王益谦为本文共同第一作者。朱艳红教授、张燕副教授和新加坡南洋理工大学Pu Kanyi教授为论文共同通讯作者。华中科技大学生命科学与技术学院为论文第一通讯单位。