2022年2月14日,华中科技大学生命科学与技术学院王晨辉教授团队在国际权威期刊《Nature Communications》上发表题为“Cancer cell-expressed BTNL2 facilitates tumour immune escape via engagement with IL-17Aproducing γδ T cells”的最新研究成果。

近年来,肿瘤免疫疗法取得了突飞猛进的发展。其中,位于肿瘤免疫疗法前沿的免疫检查点抑制剂(主要包括 CTLA-4 和 PD-1/PD-L1 这两类免疫检查点抑制剂)对于多种癌症类型都表现出较好的疗效。虽然 CTLA-4 和 PD-1/PD-L1 这两类免疫检查点抑制剂在临床应用上取得了明显的肿瘤治疗效果,但不尽理想的是,肿瘤患者对于当前免疫检查点抑制剂治疗的总体反应率仍然很低(约 10–30%),提示在不同的肿瘤类型或不同患者的肿瘤中可能还存在其它的免疫抑制分子或机制导致抗肿瘤免疫功能失调。因此,寻找新的肿瘤免疫抑制分子,并针对这些新靶点进行阻断剂的研发是目前肿瘤免疫研究的重要领域之一。
嗜乳脂蛋白样-2(Butyrophilin-like 2,BTNL2)是一种在肠道高表达的 I 型跨膜免疫调节蛋白,属于类嗜乳脂蛋白家族成员。先前的研究报道,BTNL2-Fc融合蛋白能够直接抑制CD4+ T细胞的活化。有意思的是,也有报道称BTNL2的单核苷酸多态性与多种自身免疫疾病以及癌症的易感性有关。最近的一项临床研究发现,BTNL2和其他免疫检查点分子(包括CTLA-4)的表达在抗PD-1抑制剂治疗后显著增加,进一步表明BTNL2可能代表了一种新的癌症免疫逃避机制。
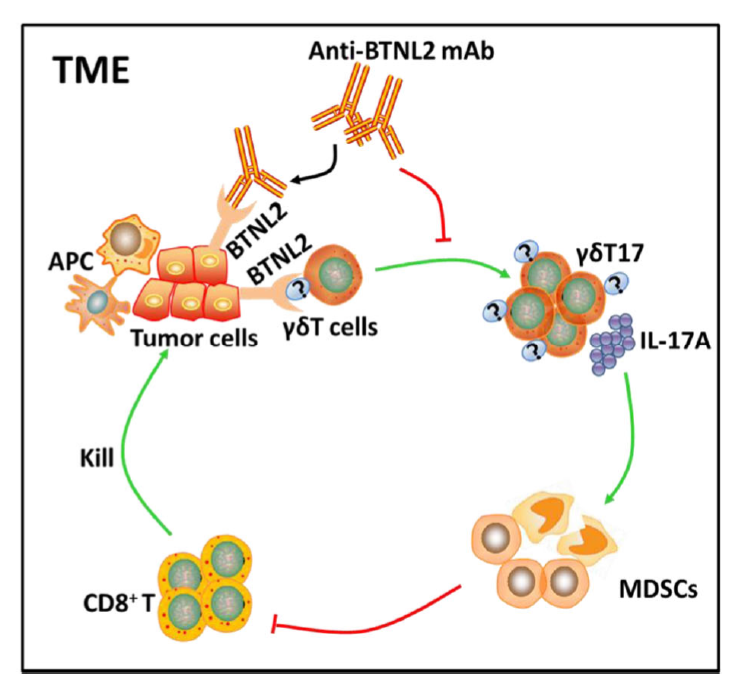
通过研究,我们发现BTNL2通过作用于肿瘤微环境的γδ T细胞群,促进IL-17A的产生,IL-17A通过招募MDSCs,导致细胞毒性CD8+ T细胞浸润减少,从而抑制抗肿瘤免疫。我们用一种新型单克隆中和抗体阻断BTNL2后,发现对多种小鼠肿瘤有显著的治疗作用,并与抗PD-1抗体抑制剂具有一定的协同治疗作用。我们进一步的研究发现BTNL2在人类肿瘤中的表达与患者预后以及表达IL-17A的γδ T细胞浸润高度相关。通过癌症芯片染色和分析研究,我们发现与表达高水平BTNL2的肺腺癌以及结肠腺癌患者相比,表达低水平BTNL2的肺腺癌和结肠腺癌患者的生存期显著提高。另外,与匹配的癌旁组织相比,几乎所有检测的癌症样本中BTNL2的蛋白水平均显著升高。因此,BTNL2不仅是癌症免疫治疗的一个有吸引力的候选靶标分子,而且有可能作为肺腺癌诊断的生物标志物。总之,我们的研究发现BTNL2是一个很有潜力的癌症免疫治疗靶点,针对BTNL2的抗体抑制剂药物有可能提高目前可用的肿瘤免疫疗法的疗效,也可能为目前癌症免疫治疗耐药的患者提供替代的治疗选择。
该工作还存在一些重要的科学问题有待将来进一步研究:1)BTNL2在T细胞表面的受体是什么分子?2)我们的研究以及以往众多研究发现BTNL2能够直接抑制CD4+ T细胞和CD8+ T细胞的激活,其抑制T细胞激活的机制是什么?这一机制是否也在抗肿瘤免疫逃逸中也发挥了一定的作用?3)该研究主要采用小鼠皮下瘤模型。BTNL2在自发肿瘤或药物诱导肿瘤模型中是否也发挥作用?其发挥作用的机制是否与皮下瘤有所不同?4)BTNL2的单核苷酸多态性或表达变化与前列腺癌、黑色素瘤、乳腺癌等多种癌症的易感性相关,BTNL2在其他癌症中是否也发挥了抗肿瘤免疫逃逸的作用?这些科学问题我们将进一步深入研究。
华中科技大学生命学院博士生杜艳芸和博士生彭倩文为论文的共同第一作者。华中科技大学为论文第一单位。华中科技大学生命科学与技术学院王晨辉教授为论文通讯作者。本研究得到武汉市人民医院消化内科的成镀医生和华中科技大学附属同济医院肝脏外科的张占国教授的大力协助。本研究得到国家重点研发计划和国家自然科学基金等项目的资助。
论文链接:https://doi.org/10.1038/s41467-021-27936-8