2022年5月19日,Nature Communications《自然-通讯》杂志以“Reversing insufficient photothermal therapy-induced tumor relapse and metastasis by regulating cancer-associated fibroblasts”为题在线发表了华中科技大学生命科学与技术学院、国家纳米药物工程技术研究中心杨祥良教授、甘璐教授团队完成的研究成果。
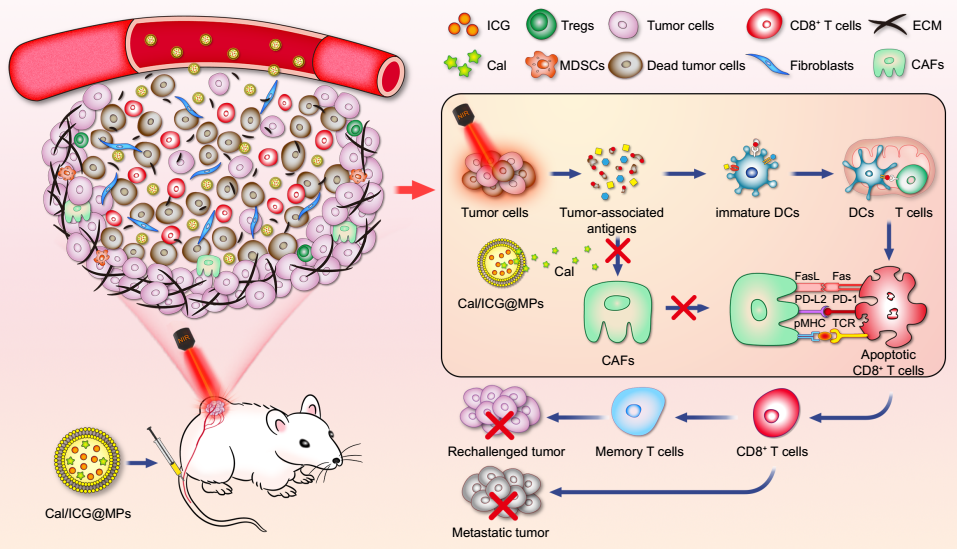
光热治疗由于具有高选择性、微创性、低副作用、可诱导抗肿瘤免疫反应等优势,成为一种有前景的肿瘤治疗手段。但由于激光穿透深度有限、肿瘤组织致密的胞外基质等限制光敏剂在肿瘤组织富集和深部渗透、肿瘤免疫抑制微环境等因素,极大影响光热治疗效果,导致肿瘤易复发和转移。肿瘤相关成纤维细胞(CAFs)是肿瘤基质微环境的重要组成部分,可分泌细胞外基质蛋白和细胞因子,在肿瘤发生发展、复发转移和免疫逃逸等方面发挥重要作用。CAFs通过分泌大量胶原、纤连蛋白等塑造肿瘤胞外基质,妨碍药物或杀伤性CD8+ T细胞浸润肿瘤组织;通过分泌TGF-β、IL-6、CCL2等细胞因子,招募免疫抑制细胞,抑制T细胞功能;另外CAFs可吞噬肿瘤抗原,通过PD-L2-PD1及FasL-Fas信号通路诱导抗原特异性CD8+ T细胞失能及死亡(AICD)。因此,通过改造CAFs、重塑肿瘤微环境对于提高光热治疗效果,改善抗肿瘤免疫反应,抑制肿瘤复发转移十分关键。
该研究设计、构建了肿瘤细胞来源的微颗粒共包载光敏剂ICG和CAFs去激活剂卡泊三醇(Cal)。该载药微颗粒(Cal/ICG@MPs)能有效靶向基质丰富的肿瘤组织,显著调控CAFs功能,重塑肿瘤胞外基质,促进ICG肿瘤组织富集并深部渗透,改善光热治疗效果;Cal/ICG@MPs产生的光热效应可诱导肿瘤细胞免疫原性死亡(ICD),促进DCs成熟及CD8+ T细胞激活,且通过Cal/ICG@MPs对CAFs改造实现CD8+ T细胞肿瘤组织招募和深部渗透,并削弱CAFs吞噬光热诱导的肿瘤抗原后所激活的AICD效应,使CD8+ T细胞在肿瘤组织增殖,产生强的抗肿瘤免疫反应,并改善肿瘤免疫抑制微环境,形成长期的抗肿瘤免疫记忆。在多种荷瘤动物模型(肝癌皮下大肿瘤、乳腺癌原位双侧瘤、乳腺癌肺转移模型)抗肿瘤实验中均证实,Cal/ICG@MPs通过调控CAFs功能显著改善光热治疗效果,有效抑制肿瘤的复发与转移。该研究不仅改善光热治疗效果,也为提高其他治疗,如化疗、放疗、免疫治疗等疗效提供新思路。
华中科技大学生命科学与技术学院杨祥良教授、甘璐教授、雍土莹讲师为论文的共同通讯作者,华中科技大学生命科学与技术学院博士生李新和雍土莹讲师为论文的共同第一作者。华中科技大学同济医学院附属同济医院张必翔教授及喻晶晶老师等参与了该工作。该研究得到了国家重点研发计划和国家自然科学基金等项目的资助。
甘璐教授、杨祥良教授团队近年来围绕仿生纳米药物,特别是基于胞外囊泡的靶向抗肿瘤纳米药物进行了系统深入的研究,主要研究成果发表在Nature Biomedical Engineering(2019)、Nature Communications(2019,2021,2022)、Nano Today(2021)、Chemical Engineering Journal(2022)、Theranostics(2022)等期刊,部分研究成果正在开展临床转化。
论文链接:https://www.nature.com/articles/s41467-022-30306-7