生理学领域的权威刊物、英国皇家生理学会会刊《生理学杂志》(The Journal of Physiology)于2022年7月1日再次以封面论文发表生命科学院陈历明课题组的研究。在这篇题为“Molecular insight into coordination sites for substrates and their coupling kinetics in Na+/HCO3– cotransporter NBCe1”的论文中,作者深入解析了NBCe1介导Na+和HCO3−进行跨膜转运的分子机制,阐明了NBCe1的底物结合位点、化学计量比及其离子转运偶联的动力学机制。杂志于同期配发了特约评论文章(Perspective),对该研究的意义给予了高度评价,并对研究的前景进行了展望。论文的第一作者为我院的博士生吴汉同学。
SLC4家族共包括5个Na+依赖的HCO3–转运体(NBC)成员,包括NBCe1(SLC4A4)、NBCe2(SLC4A5)、NBCn1(SLC4A7)、NBCn2(SLC4A10),及NDCBE(SLC4A8)。这些NBC在机体中具有十分广泛的表达和分布,参与调控神经系统的兴奋性、肾脏的重吸收、机体水电解质稳态及血压等,与一系列人类重大疾病有着密切的关系。
SLC4家族包括10个基因成员,最早被发现是3个阴离子交换体(Cl−-HCO3− exhanger),其中最具代表性的是红细胞膜上表达的AE1(SLC4A1),即所谓的带3蛋白(Band 3,红细胞膜蛋白在SDS电泳上表现为第三条带)。在NBC被发现之前,关于AE的研究已经有几十年的历史。NBCe1是第一个被发现并成功克隆的Na+依赖的HCO3−转运体。1983年,Boron和Boulpaep在爬行动物蝾螈的肾小管中首次发现了一种生电性的Na+依赖的HCO3−转运活性(J Gen Physiol,1983)。1997年,Romero等从蝾螈肾小管中克隆了NBCe1的cDNA,从而证实这种Na+依赖的HCO3−转运活性是由一种单一多肽组成的转运体负责介导的(Nature,1997)。这也是SLC4家族第四个被克隆的成员,因此被命名为SLC4A4。此后,SLC4A4基因在心脏、胰脏、神经系统等组织中表达的剪接异构体的cDNA相继被克隆。不同组织中表达的NBCe1异构体在氨基端存在结构差异(Liu Y et al, Genomics,2011)。
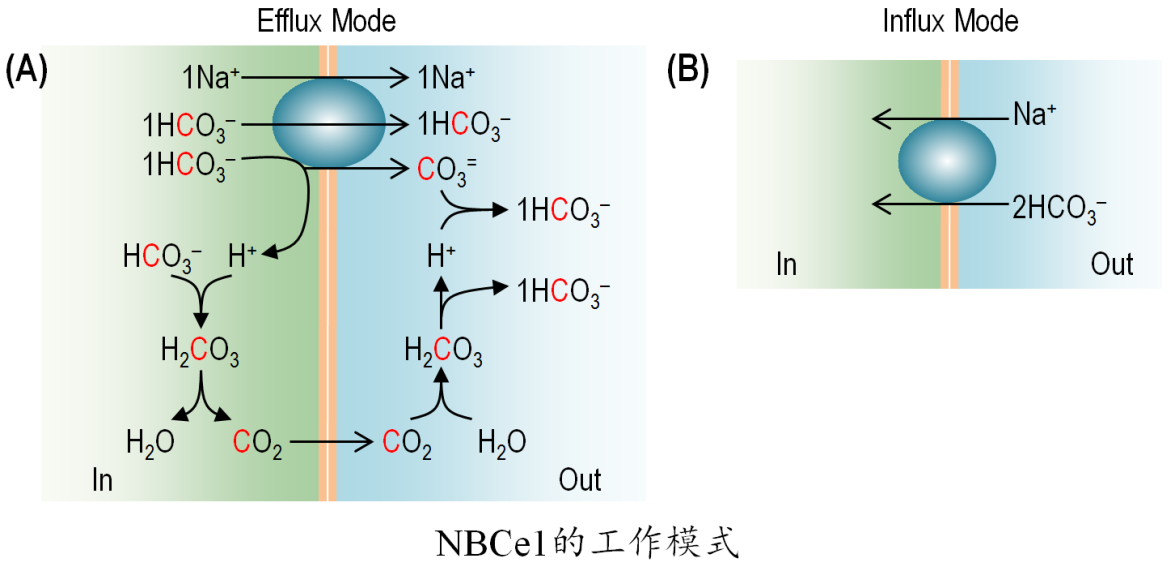
与离子通道不同的是,在离子转运体的工作机制中,底物离子需要按特定的化学比例与转运体结合,该比例即为转运体的化学计量比(stoichiometry)。研究人员关于NBCe1不同异构体的研究,导致了一场关于NBCe1化学计量比的长期争论。在最初发现NBCe1活性的研究中,Boron和Boulpaep根据NBCe1电生理学活性的特点,推断肾小管中的NBCe1转运Na+和HCO3−的化学计量比至少应该是1:2。基于大量的研究,人们发现NBCe1有两种不同的工作模式。根据热力学理论,在机体特定的生理学条件下(具体来说,包括细胞膜电位及离子跨膜浓度梯度),在肾小管上皮细胞中,异构体NBCe1-A必须按照1Na+ :3HCO3−的比例才能介导HCO3−从上皮细胞向肾小管周的转运,从而实现HCO3−的重吸收。这种工作模式定义为“Efflux模式”。而在心肌细胞、胰腺导管上皮细胞、神经胶质细胞等细胞中,异构体NBCe1-B和NBCe1-C必须按照1Na+:2HCO3−的比例进行转运,才能介导HCO3−从胞外向胞内转运,实现HCO3−的吸收。这种工作模式定义为“Influx模式”。已有的研究给人一种印象,似乎NBCe1不同的转运模式似乎与NBCe1异构体(一级结构序列的差异)有关。然而有研究发现,在不同的细胞体系中,NBCe1-A可以按1:2的比例工作,而NBCe1-B也可以按1:3的比例工作。NBCe1的真实化学计量比是什么?在不同生理条件下,NBCe1的“Efflux模式”和“Influx模式”到底有何本质区别?这些问题长期以来一直悬而未决,始终困扰着生理学家们。
在最新发表的论文,吴汉等结合已有的NBCe1冷冻电镜三维结构,通过大量的定点突变研究,首次系统地界定了Na+和HCO3–在NBCe1中的结合位点,提出了离子转运的动力学机制。其研究提供了非常充分的证据,表明在NBCe1的离子转运过程中,HCO3–的结合先于Na+。这是一个令人意外的发现,因为在已知的Na+依赖的共转运体中,Na+的结合似乎总是先于另一种底物的结合!
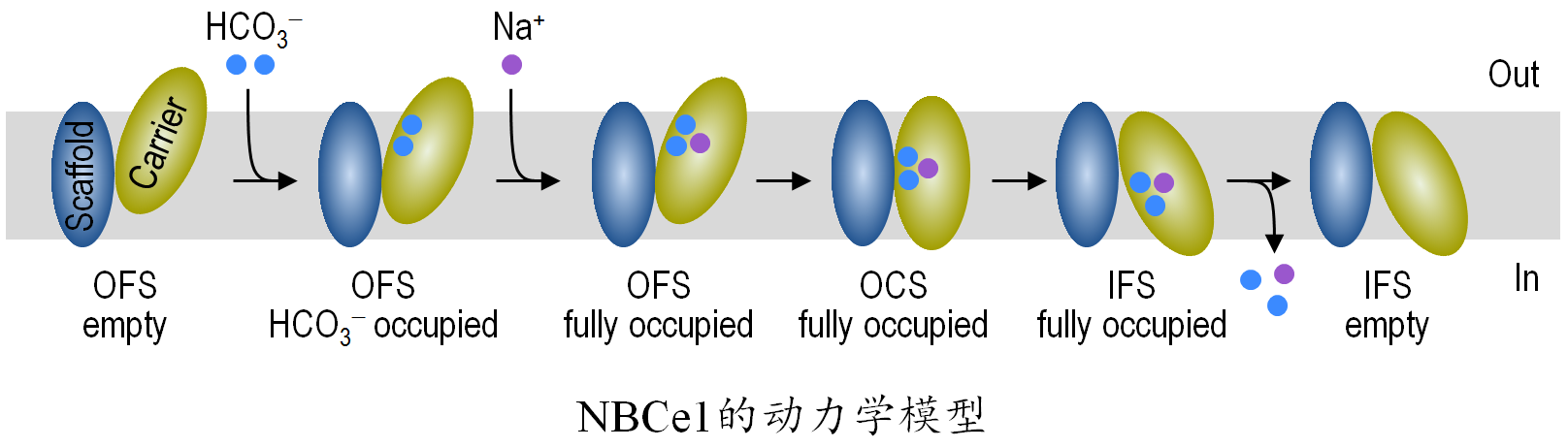
通过分子对接模拟,吴汉等发现NBCe1只有两个阴离子结合位点,而且这两个位点既可以结合HCO3−,也可以结合CO3=。根据这一发现,作者提出当NBCe1以“Efflux 模式”工作时,其实际转运1Na+ + 1 HCO3− + 1CO3=;当NBCe1以“influx模式”工作时,其实际转运1Na+ + 2HCO3−。在理论上可以证明,NBCe1转运1HCO3− + 1CO3=与直接转运3HCO3−在热力学上是完全等价的。基于大量的文献资料,吴汉等分析认为,NBCe1的工作模式(Influx模式vs Efflux模式)与NBCe1一级结构的差异无关,而可能是另由其他未知的结构因素决定的。
华中科技大学物理学院的刘士勇副教授为本研究中的分子对接模拟工作给予了非常重要的指导,省妇幼保健院赵蕾主任为本研究做出了重要贡献。
陈历明教授课题组长期从事钠离子偶联的HCO3–转运体的结构与功能、功能调控机制及生理学作用的研究,取得了一系列较有影响力的成果。
The Journal of Physiology杂志于2020年曾以封面论文发表了该课题组关于NBCn1和NBCn2在肾小管mTAL中生理学作用的研究(我院博士生王金林与王晓宇为共同第一作者)。该研究发现NBCn1和NBCn2在mTAL中具有多重重要的生理学作用。在代谢性酸中毒条件下,NBC可促进酸的排泄。在代谢性碱中毒条件下,NBC可抑制mTAL对HCO3−的重吸收,促进HCO3−的排泄;在高盐条价下,NBC可抑制mTAL对NaCl的重吸收,促进NaCl的排泄。
2021年,The Journal of Physiology杂志发表陈历明课题组的论文(第一作者为我院博士生苏攀同学),系统地阐明了NBCe1的自抑制及其被相互作用蛋白IRBIT激活的分子机制。他们的研究发现,NBCe1氨基末端的自抑制结构域AID通过与跨膜区结合,阻断Carrier domain相对于Scaffold domain的运动,使NBCe1失活。IRBIT通过蛋白相互作用使AID从跨膜区解离,从而激活NBCe1。
此外,陈历明教授课题组于2017年在著名的《美国肾脏病学会会志》(Journal of the American Society of Nephrology)发表论文(博士生郭义敏和刘颖副教授为共同第一作者),报道了大鼠近曲肾小管中存在的一种新的HCO3–重吸收途径,表明HCO3−重吸收可以由近曲小管顶膜的NBCn2介导。该研究发现挑战了教科书中的传统观点,这种观点认为肾小管中HCO3−重吸收完全由H+分泌依赖的途径介导。该研究被Nature Review Nephrology作为“研究亮点”进行了报道。
原文链接:https://physoc.onlinelibrary.wiley.com/doi/10.1113/JP282034