2022年10月 12日,华中科技大学生命科学与技术学院闫云君教授团队在国际权威期刊Chemical Engineering Journal上发表题为“Mussel foot inspired bionic adhesive material enhanced by a reconstructed in vitro system for interfacial adhesion”的研究论文。
湿粘附在医学和经济应用中具有重要地位,也是最具挑战的课题。贻贝粘胶蛋白是一种具有强大水下粘附能力的天然蛋白质,可用于表面化学、生物医学、海洋工程、日化用品等诸多领域,如医学中的手术缝粘合、促进细胞粘壁爬行、促进创面愈合抑制瘙痒、形成抗水保护膜等。贻贝粘胶蛋白在湿环境中表现出的超强界面粘附能力依赖于其自身复杂的固化调控过程,包括腺细胞内由酪氨酸酶催化的粘胶蛋白翻译后修饰反应、反应结束后的蛋白质储存、在囊泡中成熟蛋白的关键官能团——多巴的抗氧化保护、蛋白分泌后在粘附界面的延迟氧化以及水环境中pH转变等。针对这些反应机制的研究和体外模拟可帮助人们深入了解贻贝粘胶蛋白的固化调控过程,实现仿生贻贝粘胶蛋白材料的功能完善化。
本研究首先通过EDC/NHS接枝法制备了贻贝仿生粘胶蛋白前体,命名为PGA-Tyr-Arg,作为体外翻译后修饰的底物(图1c),突破了传统仿生贻贝粘附材料有效官能团含量低,湿环境中界面粘附能力弱的限制。其次,在酪氨酸酶催化的体外翻译后修饰反应过程中,比较了不同的还原剂,并发现单宁酸在反应过程中对酪氨酸酶的酶活抑制作用最小且具有不错的抗氧化作用,适合作为酶催化反应过程中的还原剂(图1a),贻贝仿生粘胶蛋白Mfp6(PGA-Cys)具有更强的酪氨酸酶酶活抑制作用和抗氧化作用,适合作为蛋白质存储阶段和界面粘附初期的还原剂(图1d),揭示了贻贝粘胶蛋白在分泌前的翻译后修饰和存储的不同阶段同样需要复杂的氧化还原保护。最后,设计制备了一种采用亲和吸附法的固定化酶,IEAMNP-Cu2+-Tyrosinase (图1b),适合于催化大分子底物的反应,酶活相对于游离酪氨酸酶催化剂提高了1.5至3倍 (图2e),实现了体外反应后修饰反应中酪氨酸到多巴的高转化率(约93%)(图2c),突破了传统游离酶在体外环境下的催化活性低的限制。在上述条件下制备的粘胶蛋白可在湿环境中实现高达9.5MPa (图2f) 的抗剪切粘附力,且有望进一步提高,使仿生贻贝粘附材料在保留其对水环境的强耐受性基础上,进一步提高界面粘附力,以满足更具挑战性的应用需求。
闫云君教授团队致力于研发生物基水下粘附新材料,并取得了一系列重要进展,本研究成功构建了贻贝粘胶蛋白细胞外功能化体系(Li et al., CHEM. ENG.J. 452 (2023) 139580)。

图1 (a)本研究的技术路线,(b)催化剂IEAMNP-Cu2+-Tyrosinase的合成方法,(c)Mfp35仿生蛋白前体(PGA-Tyr-Arg)的制备过程,(d)Mfp6仿生蛋白(PGA-Cys)的合成
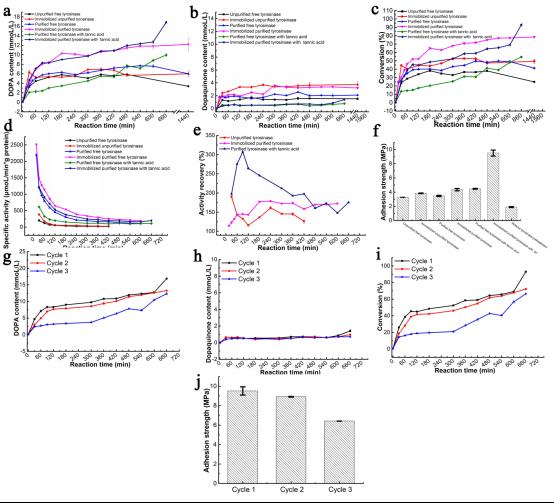
图2 游离酶和固定化酶在不同处理条件下的比较(a-f)和固定化酶IEAMNP-Cu2+-Tyrosinase的可重用性(g-j)
华中科技大学生命科学与技术学院的闫云君教授为论文通讯作者,李凯博士后为论文第一作者。本研究得到国家自然科学基金、华中科技大学自主创新基金的资助。
文章链接:https://doi.org/10.1016/j.cej.2022.139580