2023年1月28日,华中科技大学生命学院、国家纳米药物工程技术研究中心李子福教授与同济医院孙朝阳教授在国际权威期刊Nano Today上合作发表题为“Mild photothermal therapy boosts nanomedicine antitumor efficacy by disrupting DNA damage repair pathways and modulating tumor mechanics” 的研究论文。
乳腺癌是世界上最常见的女性恶性肿瘤,发病率和死亡率都很高。研究者们在各种治疗策略上做出了大量的努力,而靶向DNA损伤修复(DDR)途径的治疗策略最近成为治疗乳腺癌的一个有希望的选择。聚腺苷二磷酸核糖聚合酶(PARP)作为参与DNA损伤修复的关键酶已经成为抗肿瘤药物开发的重要靶点。通过抑制单链DNA损伤修复的PARP抑制剂已被应用于乳腺癌的临床治疗。但是,大量研究表明PARP抑制剂只对存在同源重组(HR)缺陷的乳腺癌患者有益。与此同时,当PARP抑制剂与其它DNA损伤药物联合使用时,经常会观察到对正常组织的剂量限制性毒性。并且,乳腺癌异常的力学微环境限制了药物在肿瘤组织的富集与穿透。这些因素严重制约了基于PARP抑制剂的肿瘤治疗在乳腺癌治疗中的应用。
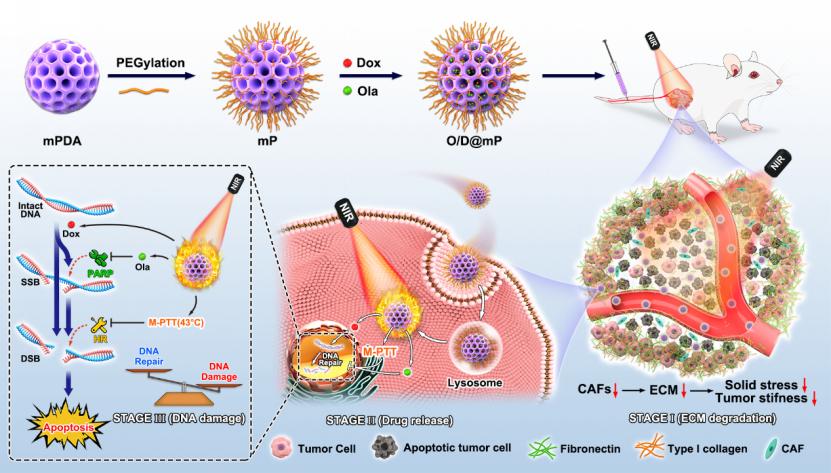
图1. O/D@mP的制备及其作用机制示意图
针对以上乳腺癌治疗中面临的困境,本工作使用简单的策略将奥拉帕利(一种已经被批准用于临床的PARP抑制剂)和阿霉素(一种典型的DNA损伤化疗药物)共同载入聚乙二醇修饰的介孔聚多巴胺纳米粒中,以治疗HR健全的三阴性乳腺癌(图1)。在这一纳米载药系统中,介孔聚多巴胺不仅作为药物载体,而且作为光热产生器。我们发现介孔聚多巴胺产生的局部温和光热效应(M-PTT,43 ℃左右)能够通过大幅降低HR相关蛋白MRE11、RAD51和BRCA2的表达来抑制HR修复途径。同时,体内实验结果表明,M-PTT可以通过缓解乏氧以有效抑制肿瘤相关成纤维细胞(CAFs),并减少乳腺癌致密细胞外基质(ECM)。此外,ECM的减少使肿瘤力学和肿瘤血管正常化,提高药物在肿瘤部位的富集和渗透。因此,在M-PTT的帮助下,这种纳米载药系统能够诱导强有力的DNA损伤,从而增强抗肿瘤疗效,同时最大限度地减少全身副作用。这项工作突出了M-PTT对DNA损伤修复功能的抑制和对肿瘤力学的改善。考虑到M-PTT是一种安全、特异且非侵入性的辅助治疗策略,这种具有光热性能的纳米载药系统在未来的临床治疗中具有广阔的应用前景。
此项工作是李子福教授课题组在肿瘤力学微环境调控方向的又一重要研究成果。李子福教授长期从事改善实体瘤力学微环境以增强纳米药物抗肿瘤作用方向的研究。2018年至今,李子福教授课题组在Advanced Science、Nano Today、Journal of Controlled Release、Nano research, Nanoscale、Journal of Materials Chemistry B等国际权威期刊上发表了一系列研究论文,系统阐释高压氧、转化生长因子(TGFβ)抑制剂、组织型纤溶酶原激活剂(tPA)以及光热调控肿瘤力学微环境的具体机制。本研究是前期工作的进一步拓展,阐明了同时调控肿瘤力学微环境及DNA损伤修复途径对乳腺癌治疗的增效作用。
华中科技大学生命学院博士生熊雨轩,同济医院博士生王伟为该文章的共同第一作者。生命学院李子福教授和同济医院孙朝阳教授为该工作的共同通讯作者。该论文得到国家重点研发计划项目、国家自然科学基金、以及华中科技大学学术前沿青年团队(生物力纳米肿瘤学)等项目的资助。
论文链接:https://doi.org/10.1016/j.nantod.2023.101767