12月29日,美国化学会旗下期刊《美国化学会 纳米》(ACS Nano)在线发表华中科技大学生命科学与技术学院、国家纳米药物工程技术研究中心赵彦兵教授和杨祥良教授的研究论文“Radiofrequency-Activated Pyroptosis of Bi-Valent Gold Nanocluster for Cancer Immunotherapy”。
癌症免疫治疗在杀伤肿瘤细胞表现出巨大的潜力。但其仅对小部分具有 "免疫原性热肿瘤 "特征(≈10-30%)的患者有效。癌细胞死亡模式在调节肿瘤免疫微环境中发挥着重要作用。如细胞焦亡作为一种与适应性免疫反应相关的程序性细胞死亡模式,通过诱发免疫原性细胞死亡(ICD),改善细胞毒性T淋巴细胞的浸润,引发全身性免疫反应,为提高癌症免疫治疗提供巨大助力。研究表明,Gasdermin E (GSDME)蛋白在肿瘤细胞焦亡过程中起着关键作用。由于GSDME蛋白在大多数肿瘤细胞中表达水平很低,这在很大程度上抑制了肿瘤细胞焦亡,仅发生无免疫原性的细胞凋亡。尽管一些DNA甲基转移酶抑制剂(地西他滨、5-氮杂胞苷等)可以有效提高肿瘤细胞中GSDME含量,然而缺乏对GSDME蛋白的活化,仍然极大地限制了肿瘤细胞的焦亡。有报道称可以通过促进caspase 3的活化,有效地调节caspase 3/GSDME介导的肿瘤细胞焦亡,从而对肿瘤起到抑制作用。然而,如何通过caspase 3途径实现肿瘤细胞从凋亡到焦亡的特异性转变,提高癌症免疫治疗效果,仍然是一个巨大的挑战。
射频消融(RFA)是临床上最常用的热疗方法之一,在RFA外围区(热负荷<50℃),Caspase 3介导的细胞凋亡是肿瘤细胞损伤的主要途径。最近,基于射频响应性纳米颗粒(RF-NPs)的非侵入式RFA程序(射频辐射)作为一种有前景的热疗方式引起了广泛关注。相比传统RFA,它不需插入电极针,射频组织穿透深,程序灵活可精准杀伤肿瘤细胞,能活化caspase 3并在一定程度上持续激活免疫反应。在本工作中,作者采用弱还原剂和强还原剂的两步还原法,制备了射频响应型双价金纳米簇(biGC@PNA),通过温度敏感聚合物对其进行改性,以改善其体内行为(细胞摄取和瘤内保留等)。通过调节弱还原剂和强还原剂的配比来精确调节biGC@PNA中的Au(I)/Au(0)比率,实现了对射频加热效应精确调控,并在非侵入式射频场下研究了其对细胞焦亡的影响。肿瘤细胞和荷瘤小鼠中GSDME和caspase 3表达水平的变化表明,biGC@PNA表现出明确的射频热激活的肿瘤细胞焦亡,以及强烈的射频诱导ICD效应和全身免疫反应。与αPD-1的联合应用表明,射频响应biGC@PNA在抑制肿瘤肺转移、远端肿瘤和再攻击肿瘤生长方面都表现出优异的αPD-1免疫治疗增强效果。biGC@PNA作为射频激活肿瘤细胞焦亡的纳米效应器,有望成为增强癌症免疫治疗的新策略(图1)。
《ACS Nano》是全球纳米科学与材料领域的顶尖期刊。华中科技大学生命科学与技术学院博士生张清清为该论文的第一作者。该研究得到国家基础研究计划(2020YFA0710700,2018YFA0208900)和国家自然科学基金(82172758, 81773653)的资助。
文章链接:https://pubs.acs.org/doi/full/10.1021/acsnano.2c09242
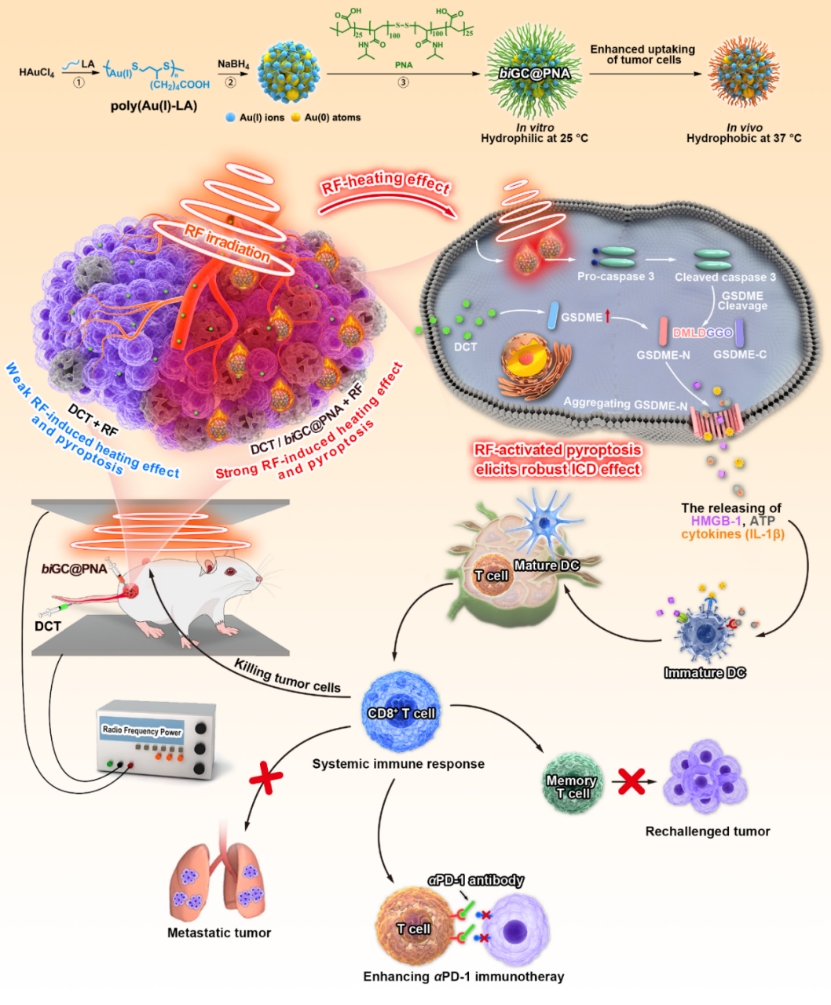
图1. biGC@PNA的射频激活肿瘤细胞焦亡用于癌症免疫治疗