(通讯员:张一漪)在最新一期出版的纳微米技术领域国际旗舰期刊《Nano-Micro Letters》(IF=16.4)中,刊发了华中科技大学生命学院、国家纳米药物工程技术研究中心罗亮教授团队与中国药科大学孙春萌副教授团队合作的题为“Time‑Programmed Delivery of Sorafenib and Anti‑CD47 Antibody via a Double‑Layer‑Gel Matrix for Postsurgical Treatment of Breast Cancer”的研究论文。该论文报道了一种新型的可注射双层凝胶实现肿瘤化疗药物与免疫治疗药物贯序释放用于乳腺癌术后治疗。

乳腺癌细胞的高侵袭性以及手术切除后的高度免疫抑制微环境导致化疗、放疗以及免疫疗法等治疗方法效果受限。由于巨噬细胞具有可塑性,将促进肿瘤生长的M2型肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)通过“再教育”为具有抗肿瘤活性的M1型,有望逆转术后免疫抑制微环境。此外,抗CD47抗体(aCD47)通过阻断CD47与信号调节蛋白α(SIRPα)的相互作用,能够激活吞噬细胞与效应T细胞介导的免疫应答,增强抗肿瘤疗效。因此,在CD47免疫阻断治疗之前,优先对肿瘤术后的TAMs进行“再教育”,有望建立一个整体免疫有利的微环境,以提高抗肿瘤效果。
罗亮教授与中国药科大学孙春萌副教授联合团队在这项研究中构建了由不同比例的大豆卵磷脂/二油酸甘油酯组成的可注射双层凝胶,以实现贯序释药、逆转免疫微环境,并且结合免疫阻断疗法,从而更好地防止乳腺癌术后复发与转移。双层凝胶的外层具有热响应性,并负载吸附有索拉菲尼(SRF)的氧化石墨烯(GO)纳米粒子。GO在人工控制的近红外照射下产生较为温和的热量,首先刺激SRF的释放,对TAMs进行再“再教育”,促进免疫原性微环境的形成。内层凝胶负载aCD47,能够长时间维持凝胶状态,使得aCD47持续释放,阻断CD47与SIRPα通路,实现长期的抗肿瘤效果。体内4T1荷瘤小鼠模型研究表明,基于双层凝胶的贯序释药策略通过逆转局部免疫抑制,协同阻断CD47介导的免疫逃逸,能够增强全身免疫反应,有效地防止肿瘤复发与转移。
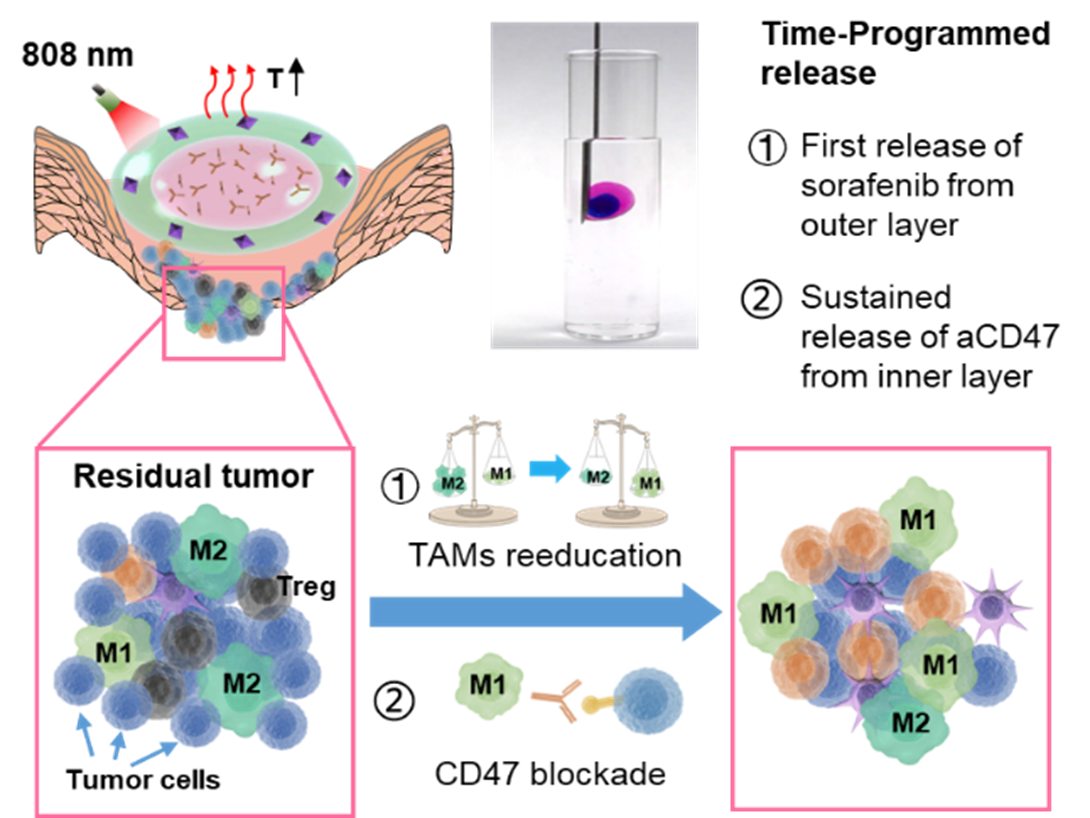
本研究开发了一种新型可注射双层凝胶,实现了基于时空分布的多种药物按需贯序释放,验证了优先释放适宜剂量的化疗药物索拉菲尼能够对肿瘤相关巨噬细胞进行“再教育”并增强抗肿瘤术后免疫治疗的效果,为提升肿瘤免疫治疗临床响应率提供了新思路。
华中科技大学生命学院博士后黄丽萍博士、硕士生张一漪同学、中国药科大学李亚楠博士为该论文的共同第一作者,华中科技大学生命学院为该论文第一通讯单位。该研究得到国家重点研发计划(2018YFA0208903)和华中科技大学引进人才启动经费的资助。
论文链接:http://doi.org/10.1007/s40820-021-00647-x