(通讯员韩云巧)日前,华中科技大学生命科学与技术学院刘木根教授团队在造血干细胞发育研究中取得重要进展。2月21日,国际血液学权威期刊Blood杂志以封面文章发表该团队研究论文“BCAS2 is essential for hematopoietic stem and progenitor cell maintenance during zebrafish embryogenesis”(Blood. 2019;133(8):805-815)。该论文发现剪接因子BCAS2调控造血干细胞的发育与分化,从而揭示新的血液发生和调控机制。生命学院博士后于珊珊与蒋涛副教授为该论文并列第一作者,刘木根教授与武汉大学基础医学院罗大极副教授为共同通讯作者。
人和动物的血液形成是一个有序而复杂的动态过程,造血机制在脊椎动物中高度保守。造血干细胞的发生、分化与成熟受多种转录因子和表观遗传因子的精细调控,其缺陷可引起多种疾病,包括贫血、免疫缺陷以及白血病等。近年来国外研究发现一些剪接因子基因突变与骨髓增生异常综合征(MDS)以及继发性急性髓系白血病(sAML)等密切相关,提示剪接调控在造血干细胞发育和分化过程中起着重要作用。
BCAS2基因首先在乳腺癌细胞中克隆,随后的研究发现其表达产物BCAS2蛋白是剪接体的一个重要组成成分,参与前体mRNA到成熟mRNA的剪接过程。BCAS2在调节细胞生存和发育过程中发挥重要作用。刘木根课题组前期研究发现,BCAS2能够调控HSF4蛋白稳定性和转录活性,在维持晶状体发育和分化中发挥作用,但其是否在体内造血发育过程中发挥作用尚未有研究。
为探讨BCAS2在体内的生理功能,刘木根课题组和武汉大学罗大极副教授合作,应用基因编辑技术构建了BCAS2斑马鱼基因敲除模型。在斑马鱼中BCAS2与造血干细胞存在共定位,敲除BCAS2导致斑马鱼次级造血干细胞的形成显著减少。分析造血干细胞发育和分化异常的分子机制,他们发现BCAS2突变导致p53及其下游靶基因的表达显著升高,进而促进造血干细胞发生凋亡。进一步机制研究发现BCAS2参与MDM4的剪接,在斑马鱼中敲除BCAS2引起MDM4基因第6外显子发生异常剪接,而正常MDM4表达下调,从而促进了p53的转录活性,最终导致造血干细胞凋亡。
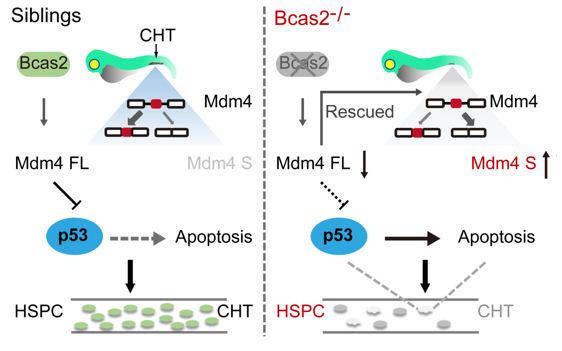
于珊珊等的研究结果表明,剪接因子在造血干细胞发育和分化过程中发挥重要作用。由于剪接因子在生物基本生命过程中发挥重要作用,其纯合突变导致个体发育胚胎致死,因而它们在生物体发育过程中的生物学效应一直未能得到很好的研究。斑马鱼具有胚胎体外发育和胚胎透明便于观察的优势,是研究早期发育的良好动物模型。斑马鱼的造血过程与哺乳类动物非常相似,也分为初级造血和次级造血。次级造血产生多能造血干细胞和各种分化血液细胞,提供动物终生的需求。
Blood杂志同期配发了芝加哥大学de Jong教授的题为“Splicing up hematopoietic development ”评述文章(Blood 2019;133:770-771),对该成果进行了高度评价。de Jong教授认为该论文将引发不同剪接因子在造血作用机制的后续研究,揭示造血干细胞形成、维持、分化的新的分子机制。进一步研究还可能发现更多调控HSPCs发育以及恶性转化的差异剪接mRNAs,并为利用小分子或其它治疗手段,直接诱导HSPC分化或靶向治疗血液肿瘤提供新的切入点。
该研究工作得到国家自然科学基金、华中科技大学自主创新基金,以及华中科技大学生命科学与技术学院研究平台的资助。
论文链接:http://www.bloodjournal.org/content/133/8/805