2024年4月22日,华中科技大学生命学院朱斌教授团队与武汉大学王隆飞、北京大学刘小云、牛津大学吴迪团队合作在微生物领域顶级期刊《Nature Microbiology》发表题为“Phage defense system CBASS is regulated by a prokaryotic E2 enzyme that imitates the ubiquitin pathway”的研究论文。
论文链接:https://rdcu.be/dFpbY
DOI: 10.1038/s41564-024-01684-z
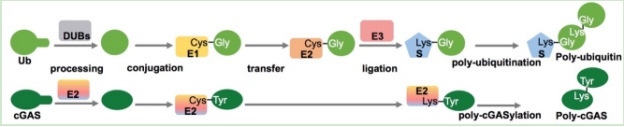
近期发现的新型原核生物免疫系统中与真核生物免疫系统最相关的当属CBASS (基于环寡核酸的抗噬菌体信号系统,cyclic oligonucleotide based anti‑phage signaling systems),由于直接相关于哺乳动物先天免疫cGAS‑STING通路的起源,CBASS受到高度关注。在当前对CBASS系统中的信号合成元件和信号接收元件的研究热潮中,朱斌团队独辟蹊径关注到一类CBASS附属调控元件并首次对其功能和调控机制开展研究。在已知基因组的细菌中根据序列同源性预测有超过10%(>6000种)含有CBASS,其中超过600种CBASS除了编码一个典型的环寡核酸合成酶cGAS和一个受环寡核酸信号分子激活的效应蛋白质之外还编码一个与真核生物泛素结合酶E2同源的未知功能蛋白质。通过生化、分子、细胞、遗传和结构研究手段,朱斌团队及合作者展示了一个单独原核生物E2酶模拟真核生物至少五个蛋白质(E1、E2、E3、蛋白酶、蛋白质受体)才能完成的泛素化调控催化形成共价多聚poly-cGAS并激活其合成cGAMP免疫信号的新机制,为泛素系统的进化提供了线索。在蛋白质化学机制方面,与泛素化过程中普遍产生甘氨酸—赖氨酸异肽键不同,细菌E2在蛋白质连接过程中识别甘氨酸但连接时将其切除,与分选酶(Sortase)连接机制接近。本研究报道了一种新的蛋白质修饰化学机制并发现已知唯一具有蛋白酶活性的E2结合酶。
华中科技大学博士生闫艳、武汉大学博士生肖军、华中科技大学博士后黄锋涛、北京大学博士生冼伟为论文共同第一作者;朱斌、王隆飞、刘小云、吴迪及黄锋涛为共同通讯作者;华中科技大学为论文第一单位。本研究受到国家自然科学基金原创探索项目及深圳市基础研究重点项目等经费支持。