2024年4月25日,华中科技大学龚健科教授课题组与中科院物理所姜道华研究员课题组合作,在Nature Structural & Molecular Biology杂志在线发表了题为“Structural insights into double-stranded RNA recognition and transport by SID-1”的研究论文。该研究首次解析了线虫系统性RNAi的关键蛋白SID-1、SID-1/dsRNA复合物以及人源同源蛋白SIDT1和SIDT2的高分辨率结构,阐明了SID-1介导的胞外dsRNA识别和转运机制,填补SID-1及其人源蛋白结构方面的空白,为未来SID-1蛋白在RNA药物递送与精准医疗应用方面奠定理论依据。
RNA干扰(RNA interference,RNAi)是双链RNA(Double-stranded RNA,dsRNA)启动的序列特异性基因沉默的保守过程,已被广泛用作基因功能研究,是潜在RNA药物治疗的重要工具。RNAi作用机制最初在秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)中发现,随后研究表明也广泛存在于植物、真菌和后生动物中。有趣的是,C. elegans存在系统性RNA干扰(Systemic RNAi),即沉默信号可以在细胞和组织间进行传递。众多实验证据表明在系统性RNA干扰缺陷(Systemic RNA interference defects,SID)线虫品系中,编码跨膜蛋白基因sid-1对于dsRNA在细胞间的摄取和传播是必不可少。SID-1蛋白在大多数动物中都有保守的同源物,其中人源同源蛋白SIDT1和SIDT2参与包括自噬、免疫反应和脂膜代谢等多种生理过程,其失调或者突变可导致多种人类疾病。但SID-1蛋白结合和转运dsRNA的机制尚不清楚,例如:SID-1如何特异性识别互作dsRNA而非DNA;对前人提出的SID-1蛋白是“dsRNA通道”假说缺乏结构信息证据;SID-1蛋白介导dsRNA摄取和转运形成系统性RNA干扰的分子机制也尚不清晰;其保守的人源同源物SIDT1/2是否参与microRNA、dsRNA转运也尚不清楚。
研究人员首先通过单颗粒冷冻电镜技术解析了SID-1蛋白分辨率2.7 Å的结构(如图1),发现SID-1以保守的同源二聚体形式存在,高度110 Å,长度70 Å,宽度42 Å。N端300多个氨基酸组成细胞外结构域(Extracellular Domain,ECD),ECD下方是由11次跨膜螺旋组成的跨膜结构域(TMD)。其二聚体形式和保守的Zn2+位点在SID-1介导的dsRNA摄取中起关键作用。结构证据也解释了SID-1的一些点突变会导致C. elegans的系统性RNA干扰缺陷表型的原因。
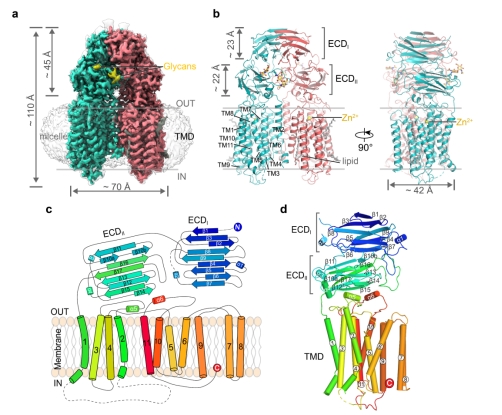
图1. SID-1的整体结构
a. SID-1蛋白的Cryo-EM密度图,两个同源二聚体分别用红色和绿色展示,黄色部分为糖基化位点;b. SID-1蛋白的原子模型;c. SID-1的拓扑结构,以N端蓝色到C端红色的彩虹色展示;d. SID-1蛋白单个原体的结构展示。
进一步的研究解析了SID-1/dsRNA复合物结构(图2),发现了SID-1识别dsRNA的机制。dsRNA结合在胞外区ECDI和ECDII结构域之间,大约25 bp长度的dsRNA与ECD直接相互作用。dsRNA与SID-1的结合并没有改变二聚体整体结构,TMD(42 Å x 70 Å)不具有任何明显的溶剂可达通道,更没有可供直径20 Å的dsRNA通过的孔径,SID-1蛋白更像是dsRNA的受体,而不是前人推测的dsRNA的通道。进一步结构分析发现了SID-1与dsRNA的互作机制,ECD三个正电区域I-III通过与dsRNA的磷酸基团的静电相互作用和dsRNA核糖2'-OH基团形成的氢键将dsRNA牢牢“抓住”,也通过MST实验证实了结构上的分析。从结构上也解释了SID-1蛋白特异性识别dsRNA而非dsDNA的匹配机制,首先dsRNA与dsDNA的形状差异导致dsDNA与SID-1的ECD之间存在不适当的相互作用;然后dsRNA的核糖2'-OH基团和SID-1的极性残基之间至少形成了4对有助于dsRNA结合的氢键,DNA则缺乏这一关键要素。
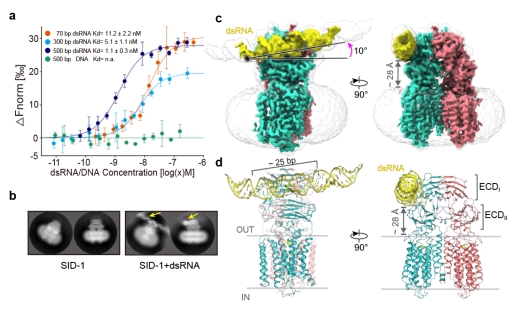
图2. SID-1/dsRNA复合物结构
a. SID-1蛋白体外MST实验检测与不同长度dsRNA和dsDNA亲和力。b. SID-1/dsRNA在2D分类中的dsRNA特征密度。c. SID-1/dsRNA 的电镜密度图,黄色部分表示的是dsRNA。d. 对应c图map的结构模型。
此外,通过冷冻电镜解析了SID-1人源蛋白SIDT1和SIDT2的结构(图3),整体结构与SID-1非常相似,以同源二聚体的形式存在。但未发现人源SIDT1/2结合和摄取dsRNA的证据。有研究发现保守的Zn2+位点是SIDT2的酶活中心,具有神经酰胺酶的活性,未来的研究可能需要深入探究SID-1同源物的蛋白酶活性及其他生理功能所涉及的潜在分子机制。
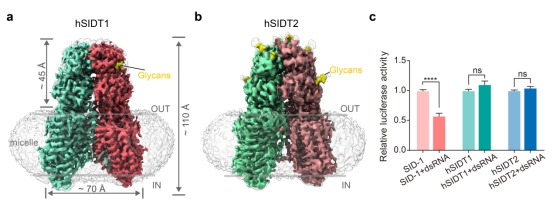
图3. SIDT1和SIDT2的结构与核酸摄取能力
a. SIDT1蛋白的Cryo-EM密度图,两个同源二聚体分别用红色和绿色展示,黄色部分为糖基化位点;b. SIDT2蛋白的原子模型;c.果蝇S2细胞的dsRNA摄取实验。
文章进一步探究了SID-1 的dsRNA转运机制(图4)。删除SID-1的Loop TM1-2不影响其细胞膜定位和dsRNA结合;然而,大大削弱了S2细胞的dsRNA摄取和C. elegans系统性RNA干扰(图4 a和b),证明了SID-1的Loop TM1-2在dsRNA摄取和转运中起着关键作用。Confocal共定位发现SID-1和dsRNA共定位于类似囊泡颗粒的亚细胞器中(图4 c),推测SID-1识别并结合dsRNA后,可能会进一步形成囊泡等亚细胞器,以内吞作用方式进入细胞。结合dsRNA/SID-1复合物结构以及dsRNA转运机制的探究,最终提出了SID-1介导的系统性RNA干扰可能的工作模型(图4 d),SID-1作为dsRNA的受体,首先利用胞外结构域ECD识别和捕获细胞外游离的dsRNA,SID-1蛋白的Loop TM1-2可能被细胞质中某些囊泡运输相关蛋白识别并产生内吞作用信号,生成亚细胞器囊泡,随后内化的dsRNA一部分被释放到细胞质中,经过一系列胞内反应最终导致产生细胞自主的RNAi,另外一些分泌到邻近细胞中启动系统性RNA干扰。由于SID-1膜定位、对dsRNA的高特异性结合和囊泡内吞等特点,SID-1可能成为RNAi药物的载体,在RNA药物靶向递送技术如人工纳米载体、外泌体等方面有潜在的应用价值。
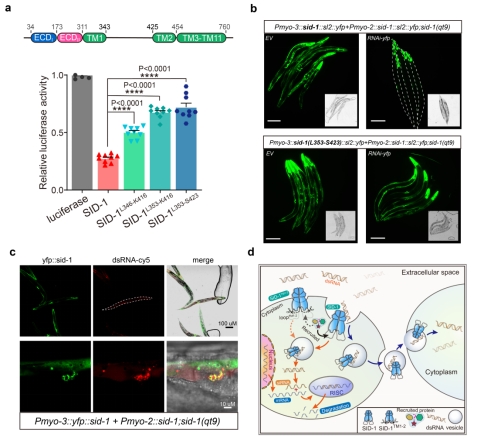
图4. SID-1的dsRNA转运机制
a. SID-1 TM1-2截短体的S2细胞dsRNA摄取实验。b. SID-1截短体系统性RNAi产生缺陷。c. Confocal共聚焦观察SID-1蛋白与dsRNA的共定位。d. SID-1介导的系统性RNA干扰可能的内吞工作模型。
总的来说,本研究提供了对SID-1介导的dsRNA识别和转运的机制性见解,填补了SID-1及其人源蛋白结构方向的空白。SID-1未来有望成为潜在的RNA药物载体与精准医疗方面的有效工具。

华中科技大学为文章第一单位,华中科技大学龚健科教授、中国科学院物理研究所姜道华研究员本研究论文的通讯作者。华中科技大学与中科院物理所联合培养博士研究生张江涛、华中科技大学博士研究生展春华、硕士研究生伍点,北京大学副研究员范俊萍和中国农业科学院博士研究生张瑞雪为共同第一作者。中国科学院生物物理研究所生物成像平台为本研究提供了设备和技术支持。本研究获得了国家脑科学与类脑智能技术项目、华中科技大学术前沿青年团队项目、中国科学院战略性先导科技专项(B类)、国家自然科学基金委员会项目的资助。
华中科技大学龚健科教授团队一直专注于感知膜蛋白结构功能研究,特别是环境中的物理信号,例如光与温度,的神经感知机制与感知受体蛋白功能的研究有夯实的基础。研究团队以模式动物线虫为研究对象,发展有特色的液体大规模发酵培养线虫的方法来进行膜蛋白受体复合物的原位分离纯化,为研究大型膜蛋白机器结构功能提供重要的研究手段。
相关论文信息:
DOI: 10.1038/s41594-024-01276-9.
URL: https://www.nature.com/articles/s41594-024-01276-9