神经递质γ-氨基丁酸(GABA)是哺乳动物中枢神经系统中重要的抑制性神经递质,约30%的中枢神经突触部位以GABA为传递物质。代谢型GABAB受体属于C类G蛋白偶联受体 (GPCR),参与多种神经和精神疾病,包括癫痫、疼痛、焦虑、抑郁、精神分裂症、药物成瘾、Rett综合征和癫痫性脑病等。GABAB受体是由GB1和GB2两个亚基组成的异源二聚体。每个亚基又分别由胞外配体结构域(VFT),七次跨膜区(7TM)和胞内区构成。这使得GABAB受体全长结构解析及其与下游G蛋白复合体的结构解析都存在巨大的挑战,延缓了靶向GABAB的药物研发。
2020年6月3日,华中科技大学生命科学与技术学院刘剑峰课题组与浙江大学基础医学院张岩课题组联合在Cell Research以Cryo-EM structures of inactive and active GABAB receptor为题在线发表相关成果。浙江大学基础医学院博士后毛春友、华中科技大学生命科学与技术学院博士生申仓松为共同第一作者;浙江大学张岩研究员、华中科技大学刘剑峰教授为共同通讯作者。该研究国际上首次报道了人源全长异源二聚体GABAB受体的精细三维空间结构。
在该工作中,刘剑峰教授课题组首先尝试多种表达方案,不断优化非激活状态和激活状态GABAB二聚体的表达条件,筛选了激动剂、拮抗剂、变构剂的种类,优化了激活状态下形成GABAB二聚体-G蛋白复合物的方案,最终成功的为本研究提供了高质量的蛋白样品,与浙江大学张岩课题组联合通过冷冻电镜技术(cryo-EM)成功解析了GABAB受体在非激活状态和激活状态与G蛋白复合物的高分辨结构,并根据不同状态下复合物结构推断出了GPCR二聚体激活G蛋白的新机制。
1)不同状态的GABAB受体全长异源二聚体结构:包括拮抗剂结合的受体结构(图1a,分辨率2.8 Å)和激动剂与正向变构调节剂同时结合的受体结构(图1b,分辨率3.0 Å)。从高分辨的结构可以得到,GABAB受体在非激活状态时GB1和GB2的VFT都处于打开状态,TM区的作用位置处于GB1和GB2的TM3-TM5/TM3-TM5界面。激动剂的结合引起了GB1的 VFT关闭,进而诱导了两个亚基之间的TM界面重排,使得TM从非激活状态的TM3-TM5/TM3-TM5界面转换到激活状态的TM6/TM6界面。
为进一步揭示GABAB受体的激活机制,作者精确的解析了不同状态下的相互作用界面。在靠近TM3,TM5的底部上具有保守性的带电荷残基H3.55,E5.60形成了离子键,稳定了非激活的状态。而在的TM3-TM5/TM3-TM5界面的上端存在一个较深的口袋被推定的3个胆固醇占据,中部间隙被两个磷脂占据,进而稳定了非激活的结构。处于激活状态由两个TM6通过疏水相互作用形成了稳定的界面,并在TM6的中间由Y6.44,N6.45形成了一个氢键网络。作者还发现在激活,非激活两种状态的GB1,GB2亚基TM之间都被磷脂占据,并推测核心口袋中的磷脂的存在更可能是结构成分。高质量冷冻电镜结构发现正向变构剂(PAM)的口袋,主要结合GB1和GB2之间的TM6/TM6界面,揭示了PAM调节受体活性的新机制,从而打破了对PAM结合口袋的盲区。本研究工作解析了原子分辨率的全长GPCR异源二聚体的非活性和活性状态结构,为靶向GABAB药物开发提供了精确的三维空间结构信息。为针对GABAB药物的快速高效研发提供重要结构基础。
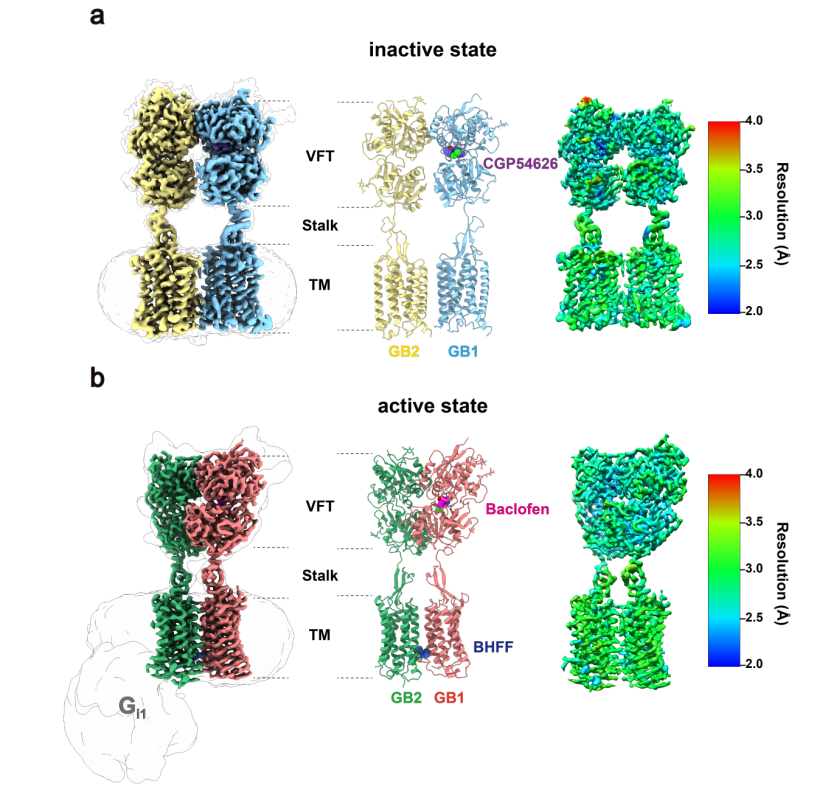
图1.GABAB受体的高质量的电镜结构,整体分辨率在2.5-3.0 Å。(a):GABAB受体的非激活状态。(b):GABAB受体的激活状态。CGP54626为GABAB的拮抗剂,baclofen是激动剂,BHFF为正向调节剂。
2)三种不同状态的GABAB-Gi复合物结构:两种与GB2结合(B2a,B2b状态),一种与GB1结合(B1状态)(图2)。结构分析证实了GABAB受体一次仅能结合一个G蛋白,并发现了GABAB受体的激活诱导了GB2 TM区的胞内环3(ICL3)的开放以及TM3、4、5的协同转移从而适应Gi-α5结构域的结合。GABAB受体与G蛋白的结合与A,B,F型的GPCR单体结合G蛋白的方式存在较大的差异,展示出了新颖的GPCR激活机制。从而揭示了二聚化的GPCR结合G蛋白新偶联机制。在理解二聚化,多聚化GPCR的激活与G蛋白偶联的领域取得了突破性进展。
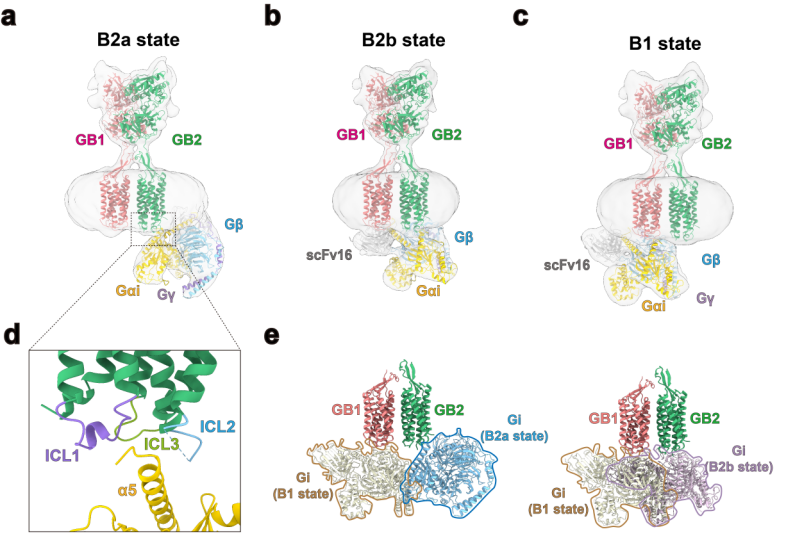
图2. (a-c):GABAB-Gi复合物存在B2a,B2b,b1三种不同的状态。其中有两种状态的G蛋白偶联在GB2亚基,一种状态的G蛋白偶联在GB1亚基。(d):GABAB受体的激活TM6没有明显外扩,其Gi-α5与GABAB受体的界面主要在loop区。(e):由于存在G蛋白的阻碍,GABAB异源二聚体在激活时只能结合一个G蛋白。
华中科技大学刘剑峰课题组长期从事跨膜受体感知外界环境变化(化学信号, 温度,光等)的分子机制和GPCR分子药理学研究,特别是对C型GPCR中的同源二聚体代谢性谷氨酸受体(mGluR)和异源二聚体代谢性γ-氨基丁酸受体(GABAB)结构、功能以及信号通路进行了系统深入的研究,先后在Cell、Nature Chemical Biology、Nature communications、PNAS、EMBO J等期刊上发表研究论文60余篇。在该项工作中,该结构也验证了刘剑峰课题组发现的mGluR (Nature Chemical Biology,2015)和GABAB(Nature communications,2019)激活后TM界面重排到TM6/TM6界面的现象以及GABAB受体不同亚基VFT区的相互作用(EMBO, 2008)。